Metanol
| Fórmula estructural | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| General | |||||||||||||||||||
| Apellido | Metanol | ||||||||||||||||||
| otros nombres | |||||||||||||||||||
| Fórmula molecular | CH 4 O | ||||||||||||||||||
| Breve descripción |
líquido incoloro con un olor agradable a acre |
||||||||||||||||||
| Identificadores / bases de datos externos | |||||||||||||||||||
| |||||||||||||||||||
| propiedades | |||||||||||||||||||
| Masa molar | 32,04 g mol −1 | ||||||||||||||||||
| Estado fisico |
líquido |
||||||||||||||||||
| densidad |
0,79 g cm −3 |
||||||||||||||||||
| Punto de fusion |
−98 ° C |
||||||||||||||||||
| punto de ebullición |
65 ° C |
||||||||||||||||||
| Presión de vapor |
|
||||||||||||||||||
| p Valor K S |
dieciséis |
||||||||||||||||||
| solubilidad |
miscible con agua, etanol y éter dietílico |
||||||||||||||||||
| Momento bipolar |
5,5 · 10 −30 C · m |
||||||||||||||||||
| Índice de refracción |
1.3288 (20 ° C) |
||||||||||||||||||
| las instrucciones de seguridad | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
|
||||||||||||||||||
| Propiedades termodinámicas | |||||||||||||||||||
| ΔH f 0 |
−239,2 kJ / mol (líquido) |
||||||||||||||||||
| En la medida de lo posible y habitual, se utilizan unidades SI . A menos que se indique lo contrario, los datos proporcionados se aplican a condiciones estándar . Índice de refracción: línea Na-D , 20 ° C | |||||||||||||||||||
El metanol ( IUPAC ), también alcohol metílico ( alcohol de madera obsoleto o alcohol de madera ), es un compuesto químico orgánico con la fórmula empírica CH 4 O ( fórmula semiestructural : CH 3 OH) y el representante más simple del grupo de los alcoholes . En condiciones normales , el metanol es un líquido transparente, incoloro, inflamable y volátil con olor a alcohol. Se mezcla con muchos disolventes orgánicos y con agua en todas las proporciones.
Con una producción anual de 60 millones de toneladas (a partir de 2012), el metanol es uno de los productos químicos orgánicos de mayor producción. La producción técnica de metanol tiene lugar principalmente catalíticamente a partir de monóxido de carbono e hidrógeno . En la industria química, se utiliza en particular como material de partida en la producción de formaldehído , ácido fórmico y ácido acético .
Además de su uso material, el metanol y sus derivados también se utilizan como fuente de energía . La tecnología de metanol a gasolina convierte el metanol en combustible. El metanol es necesario para la síntesis de biodiésel y el agente antidetonante MTBE . Con la ayuda de pilas de combustible , puede suministrar energía eléctrica. También se está discutiendo como un sistema de almacenamiento a largo plazo de alta densidad y barato para energía solar y eólica.
En la naturaleza, el metanol se encuentra en plantas de algodón , frutas y pastos y como producto metabólico de las bacterias . En la elaboración de cerveza , vinificación o producción de bebidas espirituosas , se libera en pequeñas cantidades como subproducto , principalmente a través de la descomposición de las pectinas . Los productos de degradación del metanol, especialmente el formaldehído , son venenosos. Por tanto, el consumo de metanol puede provocar ceguera, en dosis más elevadas puede provocar la muerte.
historia
Los antiguos egipcios obtenían metanol por pirólisis de madera (aguardiente de madera) y embalsamaban a sus muertos con una mezcla de sustancias a base de él. Con el proceso de destilación en seco, el químico irlandés Robert Boyle obtuvo metanol puro a partir de boj por primera vez en 1661 . En 1834, los químicos franceses Jean-Baptiste Dumas y Eugène-Melchior Péligot aclararon la composición de este líquido claro como el agua y también le dieron su nombre "metileno", derivado del griego antiguo méthy ( griego antiguo μέθυ ) para bebida o vino embriagador y hylé ( griego antiguo ὕλη ) para madera compuesta.
La primera síntesis de metanol fue lograda por Marcelin Berthelot en 1858 mediante saponificación de cloruro de metilo .
En 1930, Estados Unidos todavía extraía alrededor del 50% del metanol producido por destilación en seco de madera. Para ello, la madera se calentó a unos 500 ° C en recipientes de hierro. El carbón vegetal permaneció como un residuo sólido , los productos gaseosos se retiraron y se condensaron parcialmente. Además de metanol, el destilado acuoso resultante contenía principalmente acetona , ácido acético y acetato de metilo . La separación de estos componentes y el secado final requirió varias etapas de neutralización - destilación - y secado . El rendimiento de metanol en la destilación en seco fue aproximadamente del 1%, dependiendo de la materia prima utilizada, pero nunca alcanzó el 3% de la masa utilizada.
La BASF recibió en 1913 una patente para un proceso para la producción de metanol a partir de kohlestämmigem gas de síntesis . Matthias Pier , Alwin Mittasch y Fritz Winkler desarrollaron el proceso y lo utilizaron para la primera producción a gran escala de metanol, que comenzó en 1923 en la planta de amoníaco de Merseburg en Leuna- Werke. El proceso utiliza un tipo óxido de zinc - cromo - catalizador a una presión de 250 atm a 300 atm. Las temperaturas estaban entre 360 ° C y 380 ° C y la relación de monóxido de carbono a hidrógeno era de 1 a 2,2.
Los científicos involucrados reconocieron desde el principio que los catalizadores a base de cobre eran mucho más activos. Sin embargo, estos eran muy sensibles a los compuestos de azufre contenidos en el gas de síntesis . El mayor desarrollo de la síntesis de metanol estuvo relacionado con los avances en la tecnología de gasificación del carbón y los procesos de limpieza de gases . Después de que fue posible limitar los gases a un contenido de azufre de menos de 0,1 ppm a escala industrial , en 1966 la empresa ICI desarrolló la primera síntesis de baja presión basada en un catalizador de óxido de cobre-óxido de zinc-óxido de aluminio.
Ocurrencia
Después del metano, el metanol es el segundo gas orgánico más común en la atmósfera terrestre y se encuentra en concentraciones de 0,1 a 10 ppb . Es una importante fuente atmosférica de formaldehído y monóxido de carbono . La mayor parte del metanol en la atmósfera es emitida por plantas. En humedales se encontraron emisiones de metanol de 268 microgramos por metro cuadrado y hora, mientras que se observaron valores entre 100 y 500 microgramos por metro cuadrado y hora en pastos y pastos. El metanol se lleva a cabo mediante la liberación de pectina metil esterasa (PME) de pectina (parcialmente esterificada con ácido poli-galacturónico metanol ), como en respuesta al ataque de depredadores. Se estima que la cantidad total de metanol liberado por las plantas supera los 100 millones de toneladas por año.
Los ésteres y éteres metílicos , en los que el metanol se une químicamente, se encuentran en muchas frutas (ésteres metílicos) y en la lignina , un componente de la pared celular vegetal ( éter fenil metílico ). Los grupos de éter de metilo fenilo de los coniferılico y unidades de alcohol sinapílico presentes en la lignina de división con la absorción de agua en metanol y una fenólico residuo.
El metanol se libera periódicamente por hidrólisis enzimática del éster metílico del ácido galacturónico en la maceración . Para mantener el contenido de metanol en el producto final, lo cual es indeseable debido a la toxicidad del metanol, lo más bajo posible, se intenta minimizar la liberación de metanol mediante métodos adecuados. De esta forma, la actividad de la enzima pectolítica se puede minimizar añadiendo ácido. Además, el contenido de dióxido de azufre y la temperatura del macerado influyen en la actividad enzimática. Al calentar brevemente el macerado hasta 90 ° C y enfriarlo rápidamente, el contenido de metanol se puede reducir entre un 40% y un 90%. El contenido de metanol en el alcohol se puede mantener bajo mediante pasos de procedimiento adecuados durante la destilación, por ejemplo, mediante la condensación de componentes altamente volátiles. Las bebidas alcohólicas a veces contienen cantidades considerables de metanol. En una investigación de varios jugos de frutas y bebidas alcohólicas, la Oficina de Investigación de Baden-Württemberg encontró valores máximos de hasta 4,7 g · l −1 de metanol en bebidas espirituosas y hasta 0,2 g · l −1 en vinos y zumos de frutas .
El tabaco contiene en parte componentes que contienen lignina, cuyos fenilmetiléteres se dividen pirolíticamente y son responsables de la presencia de metanol en el humo del tabaco. El humo de fumar libera metanol de acuerdo con el mismo principio . Cuando se digiere el aspartamo , un éster metílico del dipéptido de los α- aminoácidos L - ácido aspártico y L - fenilalanina , se separa el metanol. Sin embargo, al consumir cantidades normales de alimentos endulzados con aspartamo, no se alcanzan valores toxicológicamente nocivos con respecto al metanol.
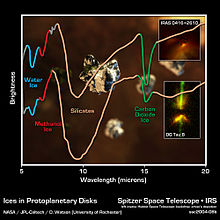
El metanol es común en el espacio interestelar , aunque no se ha aclarado el mecanismo de su formación. En 2006, los astrónomos lograron observar una gran nube de metanol con el radiotelescopio MERLIN en el radioobservatorio de Jodrell Bank . Con los instrumentos sensibles del telescopio espacial Spitzer , fue posible detectar metanol en discos protoplanetarios alrededor de estrellas jóvenes.
Fabricación
El metanol es una sustancia química orgánica básica y un alcohol a gran escala y a gran escala. En 2008, el consumo mundial de metanol fue de 45 millones de toneladas. Los mayores exportadores de metanol en 2006 fueron los países del Caribe como Trinidad y Tobago con 7.541 millones de toneladas, Chile y Argentina con 3.566 millones de toneladas y los países del Golfo Pérsico con 5.656 millones de toneladas. Los mayores importadores fueron Estados Unidos con 7.112 millones de toneladas, Europa Occidental con 8.062 millones de toneladas, Taiwán y Corea del Sur con un total de 2.361 millones de toneladas y Japón con 1.039 millones de toneladas.
La producción técnica de metanol tiene lugar exclusivamente en procesos catalíticos a partir de gas de síntesis , una mezcla de monóxido de carbono e hidrógeno en una proporción de aproximadamente 1: 2. Estos procedimientos se dividen en tres áreas según las presiones de reacción. El proceso de alta presión desarrollado inicialmente funcionó debido a la baja actividad del catalizador y la contracción del volumen de la reacción a presiones de 250 a 350 bar y temperaturas de 360 a 380 ° C. El proceso de media presión trabaja de 100 a 250 bar y de 220 a 300 ° C, el proceso de baja presión de 50 a 100 bar y de 200 a 300 ° C. Cada proceso trabaja con catalizadores específicos y proporciones de masa de monóxido de carbono a hidrógeno.
El gas de síntesis necesario para la síntesis de metanol se puede producir a partir de materias primas fósiles como carbón, lignito, fracciones de petróleo y turba. Cuando se utilizan materias primas renovables como madera, biogás u otra biomasa, el producto también se denomina biometanol. Además, la basura o los lodos de depuradora se pueden utilizar para producir gas de síntesis.
El reformado con vapor y la oxidación parcial del gas natural, la mayor fuente de hidrocarburos económicamente utilizable según las estimaciones actuales , son, además del carbón, el principal proveedor de gas de síntesis. En América del Norte y Europa, el gas natural se utiliza principalmente como materia prima; en China y Sudáfrica , la producción de gas de síntesis se basa en carbón o lignito. En 2005, China produjo 5,4 millones de toneladas de metanol, de las cuales el 65% o 3,5 millones de toneladas se basaron en carbón.
Se pueden formular las siguientes ecuaciones para la formación de metanol a partir del gas de síntesis:
y
Debido a las ventajas económicas a bajas presiones y temperaturas de síntesis, el metanol se produce principalmente mediante el proceso de baja presión. Como subproductos se forman dimetiléter , formiato de metilo y etanol y pueden separarse por destilación. Los procesos de presión media compensan la desventaja económica de la presión más alta con rendimientos más altos . El proceso de impresión tipográfica ya no se realiza en la actualidad.
China es el mayor productor y consumidor de metanol en la actualidad. Se espera que la capacidad de producción china por sí sola supere los 60 millones de toneladas por año en los próximos años. Si bien la mayor parte del metanol se usa actualmente en el sector químico, su uso en el sector de combustibles muestra las tasas de crecimiento más altas. En 2008, China utilizó alrededor de tres millones de toneladas de metanol como componente de mezcla para la producción de mezclas de combustibles . El desarrollo de motores adecuados y otros componentes del motor que sean compatibles con el metanol plantea problemas para la introducción generalizada y mayores proporciones de metanol en el combustible. En 2000, se produjeron alrededor de dos millones de toneladas en Alemania, de las cuales alrededor de 1,4 millones de toneladas se obtuvieron a partir de aceites residuales .
propiedades
| Propiedades físicas | |
| Velocidad del sonido | 1123 m s −1 (25 ° C) |
| Tensión superficial | 0,0226 Nm −1 (20 ° C contra aire) |
| Viscosidad dinámica | 0,544 10 −3 Pa s (25 ° C) |
| Constante dieléctrica | 33,8 = (25 ° C) |
| Índice de refracción | 1.326 (25 ° C, línea Na D) |
| Compresibilidad isotérmica | 12 · 10 −5 bar −1 (20 ° C) |
| Capacidad calorífica | 81,08 J mol −1 K −1 (25 ° C) |
| Temperatura de ignición espontánea | 470 ° C |
| Temperatura crítica | 512,5 K |
| Presión crítica | 8.084 MPa |
| Triple punto | 175,5 K |
| Susceptibilidad magnética | 5,3 · 10 −7 cm³ · g −1 |
| viscosidad | 0,808 mPas (0 ° C) 0,690 mPas (10 ° C) 0,593 mPas (20 ° C) 0,449 mPas (40 ° C) 0,349 mPas (60 ° C) |
| Entalpía estándar de formación | −238 kJ / mol |
| Entalpía estándar de vaporización | +37,4 kJ / mol |
| Entropía molar estándar | 127,2 J / (mol K) |
| Entalpía estándar de combustión | −726 kJ / mol |
| Ecuación de Van der Waals | a = 964,9 l 2 kPa / mol 2 b = 0,06702 l / mol |
Los alcoholes que se derivan formalmente de alcanos se denominan alcanoles . El metanol es el alcohol más simple y forma el primer miembro de la serie homóloga de alcanoles. Anteriormente, muchos alcoholes se denominan como carbinoles basados en una sugerencia de Hermann Kolbe como derivados de metanol - derivado de carbinol . Desde 1957, la IUPAC ha recomendado que esta nomenclatura ya no se utilice.
Propiedades físicas
En condiciones normales, el metanol es un líquido incoloro y fácilmente móvil. El punto de ebullición es de 65 ° C. El metanol solidifica por debajo de -98 ° C en forma de cristales incoloros. Según Antoine, la función de presión de vapor resulta en consecuencia
con P en bar y T en Kelvin, así como A = 5.20409, B = 1581.341 y C = −33.5 en el rango de temperatura de 288 a 357 K.
Debido a la polaridad de la grupo hidroxilo , enlaces de hidrógeno se forman entre los metanol moléculas . Mientras que el punto de fusión corresponde casi exactamente al del cloruro de metilo , la formación de enlaces de hidrógeno en estado líquido conduce a un punto de ebullición relativamente alto en comparación con los haluros de metilo . La energía de disociación del enlace de hidrógeno es de aproximadamente 20 kJ / mol.
El metanol forma azeótropos con una gran cantidad de compuestos orgánicos como acetonitrilo , benceno , cloroformo , ciclopentano , metacrilato de metilo y tetrahidrofurano . El metanol se mezcla con agua con una contracción de volumen . Con una fracción de volumen de 55% a 60% de metanol antes de mezclar, se obtiene un volumen de mezcla de 96,36%.
El metanol cristaliza en el sistema de cristal ortorrómbico con los parámetros de red a = 643 pm, b = 724 pm yc = 467 pm. La estructura se puede describir como un polímero de cadena unido mediante enlaces de hidrógeno. Con un enfriamiento adicional, tiene lugar una transición de fase al doblar la cadena de polímero en un sistema de cristal monoclínico .
Propiedades moleculares
La molécula de metanol consta de un carbono , un oxígeno y cuatro átomos de hidrógeno . La molécula tiene un grupo metilo con simetría trigonal y un grupo hidroxilo como unidades estructurales . Los datos sobre la geometría molecular se muestran en el croquis. El ángulo de enlace entre los átomos de carbono, oxígeno e hidrógeno es de 108,9 ° y está ligeramente contraído en comparación con el ángulo tetraédrico de 109,47 °. La longitud del enlace entre los átomos de oxígeno e hidrógeno es 96 pm y, por lo tanto, es más pequeña que la longitud del enlace carbono-hidrógeno del grupo metilo, que es 110 pm (1,10 Å), debido a la mayor electronegatividad del oxígeno.
Se determinó que la inhibición de la rotación del enlace sencillo carbono-oxígeno era de 4,48 kJ / mol y, por lo tanto, es solo un tercio de los dos grupos metilo, por ejemplo, en el etano .
Propiedades químicas
Debido al grupo hidroxilo polar, el metanol se puede mezclar con agua en cualquier proporción. La similitud con el agua se puede ver en el poder de disolución de algunas sales minerales como el cloruro de calcio y el sulfato de cobre en metanol. También es fácilmente soluble en éter dietílico , hidrocarburos y muchos otros disolventes orgánicos con exclusión de agua. En algunos solventes, incluso pequeñas cantidades de agua pueden causar separación. El metanol no es muy soluble en grasas y aceites vegetales .
El valor de pK s del metanol es 16, el metanol reacciona de forma ácida en una solución acuosa. El metanol se puede desprotonar a metanolato con bases fuertes . El metanol se puede protonar con ácidos fuertes como el ácido sulfúrico .
El metanol arde con una llama azul pálido, casi invisible al dióxido de carbono y al agua. El punto de inflamación es de 9 ° C. Los vapores de metanol forman mezclas explosivas con el aire en el rango del 6% al 50% . El metanol reacciona con metales alcalinos y alcalinotérreos para formar hidrógeno y metanolatos. Reacciona fácilmente con muchos agentes oxidantes como el perclorato de bario , el bromo o el peróxido de hidrógeno . Varios plásticos, pinturas y caucho son atacados por el metanol.
El metanol reacciona con ácidos carboxílicos en catálisis ácida o básica con la liberación de agua para formar ésteres metílicos ; Con los ésteres de ácido carboxílico , la transesterificación es posible con la liberación y eliminación del otro componente alcohólico de la mezcla de reacción o en exceso de metanol.
El metanol se puede oxidar catalíticamente a formaldehído . En la presencia de catalizadores ácidos, reacciona metanol con aldehídos y cetonas para formar hemiacetales o dimetil acetales , que pueden ser utilizados como grupos protectores en la química orgánica.
usar
El metanol se utiliza, entre otras cosas, como material de partida en la industria química o como proveedor de energía. El reciclaje de material como materia prima química requiere un producto especialmente puro. El metanol crudo se puede quemar como fuente de energía en plantas estacionarias. Una mezcla de metanol puro y agua también proporciona la energía química para el funcionamiento de las pilas de combustible, que las convierten en energía eléctrica. El uso como combustible, el llamado combustible-metanol , se está investigando intensamente. Se puede agregar a los combustibles de motor convencionales o se puede usar metanol puro. Se utiliza metanol como disolvente polar . En el proceso Rectisol , se utiliza para separar componentes ácidos como el dióxido de carbono o el sulfuro de carbonilo de las corrientes de gas. En el período de 2005 a 2009, la cantidad total de metanol materialmente utilizado aumentó alrededor de un 6%, mientras que el uso energético mostró un aumento del 55%.
Metanol como materia prima química
El metanol es un material de partida importante para la síntesis en la industria química. Cuantitativamente, son de gran importancia los derivados primarios de formaldehído, ácido acético, MTBE, metacrilato de metilo , cloruro de metilo y metil aminas . Estos se procesan en una serie de derivados secundarios y terciarios. Son ejemplos bien conocidos el acetato de vinilo , el anhídrido acético , las resinas de fenol-formaldehído y las resinas de melamina .
formaldehído
La mayor parte del metanol procesado en formaldehído se convierte por oxidación con oxígeno en catalizadores de plata o en el proceso Formox en catalizadores de óxido de hierro / óxido de molibdeno / óxido de vanadio a 400 ° C.
El mercado de formaldehído en América del Norte se contrajo alrededor de un 15% entre 2006 y 2010, en gran parte debido a la disminución de la demanda en las industrias del mueble y la construcción. El volumen de mercado en América del Norte fue de alrededor de 4 millones de toneladas en 2010. El formaldehído se utiliza principalmente en la producción de resinas de urea , fenol y melamina-formaldehído , cuyos mayores consumidores son las industrias de la construcción , la automoción y la madera . Las resinas de formaldehído se utilizan en la fabricación de productos de madera, por ejemplo, como aglutinantes para tableros duros y aglomerados . Los mercados de rápido crecimiento son la fabricación de polioximetileno , diisocianato de metileno y 1,4-butanodiol . En 2005, China era el mayor productor de formaldehído del mundo con una capacidad de 11 millones de toneladas.
ácido acético
El metanol se utiliza para la producción de ácido acético por reacción con monóxido de carbono según el proceso de Monsanto y para la producción de anhídrido acético mediante acetato de metilo según el proceso de anhídrido acético Tennessee-Eastman . La especie catalíticamente activa es el complejo de rodio aniónico cis- [Rh (CO) 2 I 2 ] - con yoduro de hidrógeno como cocatalizador .
En el ciclo catalítico, el metanol reacciona primero con el ácido yodhídrico para formar yoduro de metilo , que se agrega oxidativamente al complejo de rodio. El monóxido de carbono se inserta en el enlace metal-metilo para formar un complejo de formilo . Este se elimina del complejo como un haluro de ácido . El yoduro de ácido reacciona de nuevo con el agua para formar ácido yodhídrico y ácido acético.
En la producción de anhídrido acético , parte del producto se convierte en acetato de metilo con metanol y se retroalimenta al proceso. El anhídrido acético se obtiene íntegramente a partir del gas de síntesis.
Otro producto derivado de esta síntesis es el acetato de vinilo . Al hidrocarbonilar una mezcla de anhídrido acético y acetato de metilo en presencia de catalizadores de rodio homogéneos a temperaturas de alrededor de 150 ° C y una presión de alrededor de 40 bar a 70 bar se forma diacetato de etilideno , que se puede dividir en acetato de vinilo y ácido acético a una temperatura elevada. temperatura con catálisis ácida.
Otros derivados
El metacrilato de metilo , el monómero del metacrilato de polimetilo , se produce por hidrólisis y esterificación posterior del 2-metilpropenonitrilo formado a partir de acetonacianhidrina con ácido sulfúrico en presencia de metanol.
El metanol se puede deshidrogenar a formiato de metilo con la ayuda de catalizadores de cobre dopados . Después de la separación del hidrógeno producido, el formiato de metilo se lava primero con metanol frío y luego se separa por destilación.
Se pueden producir varios productos secundarios mediante esterificación. El clorometano se puede producir selectivamente mediante conversión con ácido clorhídrico económico . Los ésteres metílicos de ácidos grasos se pueden preparar mediante procesos de transesterificación convencionales. El tereftalato de dimetilo se obtiene mediante una oxidación de p- xileno en dos etapas con una etapa de esterificación intermedia .
La reacción de metanol con amoníaco utilizando silicatos de aluminio como catalizador produce mezclas de metilaminas , un precursor de colorantes, medicamentos y pesticidas.
Mediante la conversión de metanol para zeolitas de tipo ZSM-5 en el metanol a olefinas proceso, de cadena corta olefinas tales como etileno , propileno y butenos se pueden producir , que se obtuvieron previamente en su mayoría por craqueo a vapor de luz nafta . En el primer paso, se forma dimetiléter, que reacciona más para formar eteno con eliminación de agua .
La selectividad a productos aromáticos se puede cambiar variando las condiciones de reacción (metanol a aromáticos, MtA) .
Metanol en el sector energético
El metanol se puede utilizar como fuente de energía de varias formas. Puede utilizarse como materia prima para la conversión química en otros combustibles. Además, el metanol se puede utilizar como mezcla al 15% con gasolina (M15) o directamente como metanol puro (M100). La densidad energética (valor calorífico) es aproximadamente la mitad que la de la gasolina . El metanol puro puede servir como proveedor de hidrógeno para las pilas de combustible, o puede usarse directamente en la pila de combustible de metanol directo (es decir, sin el producto intermedio hidrógeno) para proporcionar energía eléctrica. En combinación con la generación catalítica del material de almacenamiento de energía, se puede configurar un circuito cerrado o abierto para resolver el problema de amortiguación de energía de las fuentes de energía alternativas. Varias variantes de fabricación que implican reacciones eléctricas o fotónicas ya están en uso y actualmente se están desarrollando activamente en la dirección de una mayor eficiencia. Durante la Segunda Guerra Mundial, se utilizaron mezclas que contenían metanol como combustible para motores de cohetes y aviones ( MW-50 ). Por lo tanto , la sustancia C , una mezcla de metanol, hidracina , agua y Kaliumtetracyanidocuprat (I) (K 3 [Cu (CN) 4 ]), junto con el tejido T , una alta concentración de peróxido de hidrógeno , como un autoinflamable, hipergólico combustible usado.
Metanol como combustible
| Combustible de metanol | |
|---|---|
| otros nombres |
M100, Methol, Spritol, Methyloxyhydrat, Metinol, Pyroholzether, Spiritol, Holzin, alcohol de madera, alcohol de madera, carbinol, alcohol de madera, carbinol, alcohol metílico |
| Breve descripción | Gasolina para motores adaptados |
| Componentes característicos |
Metanol |
| número CAS | |
| propiedades | |
| Estado fisico | líquido |
| densidad |
0,79 kg / l |
| poder calorífico |
15,7 MJ l −1 = 19,9 MJ kg −1 |
| Valor calorífico |
17,9 MJ l −1 = 22,7 MJ kg −1 |
| Número de octano |
106 RON |
| punto de inflamabilidad |
9 ° C |
| Temperatura de ignición | 440 ° C |
| Límite explosivo | 6–50% por volumen |
| Clase de temperatura | T2 |
| las instrucciones de seguridad | |
| un numero | 1230 |
| Número de peligro | 336 |
| En la medida de lo posible y habitual, se utilizan unidades SI . A menos que se indique lo contrario, los datos proporcionados se aplican a condiciones estándar . | |
El metanol se puede utilizar directamente como combustible o como aditivo de combustible de diversas formas. Hoy en día se conocen varias posibilidades para su uso en motores de combustión interna de gasolina y diesel . De acuerdo con la norma europea para gasolina EN 228 , se permiten mezclas máximas del 3 por ciento en volumen al combustible con la adición de estabilizadores . Los motores de gasolina actuales pueden manipular estos pequeños aditivos sin necesidad de ajustes. Por razones de costes, Alemania aún no ha hecho uso de estas posibilidades.
Además, el metanol se puede usar como una mezcla en concentraciones más altas que la gasolina o como un combustible de metanol casi puro. En Alemania, el Ministerio Federal de Educación e Investigación patrocinó una prueba a gran escala en la década de 1980 con un combustible M15, compuesto por un 15% de metanol y un 85% de gasolina, y con un combustible M85 con las proporciones correspondientes; los probó extensamente con más de 1000 vehículos de todos los fabricantes de automóviles alemanes con el apoyo de la industria del aceite mineral y numerosos institutos de investigación . Los vehículos se han adaptado en cuanto a materiales y mezclas para su funcionamiento con estos combustibles. Estados Unidos, Japón, China, Nueva Zelanda y Sudáfrica realizaron experimentos similares. Este programa también probó un combustible mixto de metanol-diesel con 20% de metanol en automóviles.
Los motores diésel de vehículos comerciales se han modificado para utilizar metanol puro (M100). Debido al bajo índice de cetano del metanol, no es posible operar el motor como un motor de encendido por compresión . Por lo tanto, los probadores utilizaron ayudas de encendido adicionales en forma de inyección de piloto diésel o encendido por chispa o encendido por incandescencia . El buque cisterna Lindanger es el tipo de buque para siete buques cisterna de productos cuyos motores de dos tiempos y dos combustibles funcionan con metanol. Los motores principales de combustible dual del tipo B&W 6G50ME-9.3 LGIB con una potencia nominal de 10,320 kW a 100 rpm se accionan con metanol y MGO como aceite de encendido . Fueron desarrollados por MAN B&W en Copenhague y construidos por el departamento de ingeniería mecánica y de motores de Hyundai Heavy Industries.
También es posible una operación de dos combustibles diesel-metanol. El motor de metanol con encendedor de metanol desarrollado por Franz Pischinger tiene buenos valores de emisión con un bajo consumo.
En los motores adaptados para metanol puro M100 y M85, en comparación con los motores de gasolina, se puede lograr hasta un 10% más de potencia del motor y aproximadamente un 15% más de eficiencia térmica , por lo tanto, un menor consumo de energía . Como combustible líquido, el metanol es particularmente adecuado para el sector del transporte debido a su fácil manejo en comparación con los combustibles gaseosos, para el transporte por carretera, agua y ferrocarril, así como, con restricciones, para la aviación.
Si bien ya no existen ventajas para las emisiones limitadas de hidrocarburos, monóxido de carbono y óxidos de nitrógeno con la tecnología de convertidor catalítico que se usa comúnmente en los motores de gasolina en la actualidad, existen ventajas menores para las emisiones no limitadas. Por ejemplo, el metanol no emite aromáticos como benceno , tolueno e hidrocarburos aromáticos policíclicos inferiores y tiene un bajo potencial de formación de ozono . Por otro lado, la desventaja es el aumento de la emisión de formaldehído, el nivel de todos los componentes de emisión enumerados aquí es muy bajo debido al catalizador. Con los conceptos de diésel, las emisiones de azufre y la formación de hollín se eliminan en gran medida . El metanol tiene casi el 50% del poder calorífico del diesel y la gasolina.
La toxicidad del metanol, que requiere medidas de precaución al repostar y al trabajar en el vehículo, es desventajosa. Dado que el metanol es biodegradable , existe poco riesgo para el medio ambiente en caso de accidente.
En el automovilismo estadounidense en la década de 1960, la serie de carreras de fórmula estadounidense ( CART , Indy Car ) reemplazó la gasolina, que no se podía extinguir con agua, por metanol después de graves accidentes de incendio en las 500 Millas de Indianápolis . Una desventaja es que la combustión de metanol puro es apenas visible. Después de repostar en la carrera, siempre se rocía agua sobre el cuello de llenado para eliminar el metanol que se haya derramado antes de que se encienda en las partes calientes. Al igual que el etanol, el metanol es especialmente adecuado para motores sobrealimentados . Los Dragsters con motores V8 sobrealimentados de ocho litros de la clase Top Methanol alcanzan potencias de más de 3500 hp.
En la construcción de modelos, se usa metanol con nitrometano agregado en motores de encendedor incandescente. Su uso está disminuyendo drásticamente porque los combustibles para la construcción de modelos son caros y los motores eléctricos modernos con baterías de iones de litio son cada vez más baratos y silenciosos.
Metanol en pilas de combustible
Hay dos formas en que se puede utilizar el metanol para obtener energía eléctrica de las pilas de combustible: o el metanol sirve como proveedor de hidrógeno para una pila de combustible de hidrógeno o se convierte directamente en la pila de combustible. Para suministrar pilas de combustible de hidrógeno, el metanol debe convertirse primero en hidrógeno y dióxido de carbono CO 2 con la adición de energía . Se utiliza un reformador de metanol para este paso (ver pila de combustible de metanol indirecto ). Luego, el hidrógeno se separa del CO 2 (y cualquier CO) y se alimenta a la celda de combustible, donde se convierte. Como alternativa a la combinación de reformador y celda de H 2 , las celdas de combustible de metanol directo adecuadas para esto pueden usar la mezcla de metanol-agua directamente, es decir, sin conversión previa en hidrógeno. Esta variante, más sencilla en cuanto a su principio funcional, es la preferida para pequeños consumidores como frigoríficos o televisores a la hora de acampar o equipos de medición. Según el fabricante, en 2018 se habían vendido más de 40.000 pilas de combustible de este tipo.
Las reacciones que se producen son:
Reacción del ánodo:
Reacción del cátodo:
Reacción general:
Este tipo de celda utiliza una membrana de intercambio de protones como electrolito . La mezcla de metanol y agua se alimenta al ánodo y el metanol se oxida allí, produciendo dióxido de carbono como gas de escape . En el cátodo , los iones de hidrógeno reaccionan con el oxígeno atmosférico para formar agua. Un problema con la celda de combustible de metanol directo es la permeabilidad de la membrana al metanol, lo que reduce la eficiencia.
Derivados del metanol como combustible
Los derivados primarios del metanol ya se utilizan de diversas formas como combustible o aditivo de combustible. Se conoce el uso del potenciador de octano MTBE, que fue aprobado en Estados Unidos en 1979 por la EPA en concentraciones entre 2 y 5%. El derivado dimetiléter (DME) se utiliza como combustible sustituto del diesel. El metanol se utiliza para la transesterificación de aceite vegetal y la producción de biodiésel. Las ventajas de los derivados incluyen su ausencia de azufre y aromáticos. La densidad de energía es más alta que la del metanol puro.
Biodiesel
En la producción de biodiesel , el metanol se utiliza para transesterificar aceites vegetales. Para ello, el aceite de colza , por ejemplo, se transesterifica con metanol bajo catálisis básica. El metanol se añade más allá de la relación estequiométrica de éster de glicerol a alcohol para desplazar la reacción hacia el lado del éster metílico . La glicerina se produce como subproducto. Una vez finalizada la reacción, las fases se separan y el biodiésel se lava y se destila para su procesamiento. Las plantas modernas de biodiesel tienen una capacidad de alrededor de 200.000 toneladas por año; la capacidad instalada total en Alemania en 2006 fue de 3.840.500 t.
Metanol a gasolina
En el proceso de conversión de metanol a gasolina, el metanol se utiliza para producir carburadores de alto octanaje . Por conversión de la zeolita - catalizadores del tipo ZSM-5 es el producto intermedio dimetiléter, se forma una mezcla de hidrocarburos . La reacción tiene lugar en el primer paso mediante la deshidratación del dimetiléter a eteno y otras olefinas ligeras, que pueden oligomerizar y ciclar en pasos posteriores a productos con cinco o más átomos de carbono . El mecanismo de reacción es complejo y ha sido objeto de una intensa investigación hasta el día de hoy.
Los tiempos de residencia son más largos y las temperaturas son más altas que con los procesos relacionados MtO y MtA. La gasolina obtenida no contiene azufre y tiene un bajo contenido en benceno . El proceso se puede llevar a cabo en un método de lecho fijo o de lecho fluido. El proceso de lecho fluido tiene ventajas a través de la regeneración continua del catalizador , que permite presiones más bajas. Total instaló una planta piloto con una capacidad de producción de 1.700 toneladas de combustible por día en Nueva Zelanda. Rheinbraun operó durante mucho tiempo otra planta piloto en Berrenrath, en Renania del Norte-Westfalia . Fue construido conjuntamente por Uhde y Lurgi .
MTBE
Por conversión catalizada por ácido de metanol con isobuteno se prepara el metil terc butil éter (MTBE), un potenciador del octano. El contenido de oxígeno del MTBE provoca una mejor combustión del combustible en los motores con carburador. La mejora del aire lograda de esta manera fue la principal razón por la cual el uso de oxigenados, un grupo de químicos que aumentan el contenido de oxígeno de la gasolina , fue prescrito en la Ley de Aire Limpio (CAA) de los Estados Unidos de 1992. Las refinerías alcanzaron el objetivo del 2,7% en peso de oxígeno en el combustible especificado en la ordenanza , principalmente mediante el uso de MTBE.
Después de que se detectara MTBE en las aguas subterráneas, en 2003 California y otros estados de EE. UU. Prohibieron el uso de MTBE como potenciador del octanaje, ya que concentraciones de alrededor de 40 µg de MTBE por litro de agua perjudican la calidad del agua potable. En Europa y Alemania, el uso de MTBE fue incrementado por la Directiva 85/535 / EEC y más tarde por la Directiva de Calidad de Combustible 98/70 / EC, según la cual se permite una mezcla de hasta un 15% en volumen. En Alemania y la UE, los estudios no han encontrado ningún peligro directo para la salud o el medio ambiente del MTBE, y no se consideró una prohibición.
Dimetil éter
El dimetiléter (DME) gaseoso fácilmente licuado se puede producir mediante la deshidrogenación catalítica de metanol en presencia de catalizadores de sílice-alúmina . Algunas empresas consideran que el DME es un combustible prometedor en motores diésel y turbinas de gas. El índice de cetano del DME es 55 y, por tanto, más alto que el del diesel convencional. La combustión es relativamente limpia y solo conduce a bajas emisiones de partículas, óxidos de nitrógeno y monóxido de carbono. El proyecto europeo BioDME está investigando si el DME producido a base de lignocelulosa puede producirse a escala industrial.
Otros usos
El metanol también se usa en muchas áreas. Se utiliza como disolvente y anticongelante . En los tubos de calor en el rango de temperatura media hasta 500 K, se utiliza metanol como fluido de transferencia . También se utiliza para limpiar los sensores de las cámaras réflex digitales de un solo objetivo , ya que no deja rayas y se evapora sin dejar ningún residuo. El metanol mono y perdeuterado se utilizan como disolventes en la espectroscopia de resonancia magnética nuclear . En las plantas de tratamiento de aguas residuales, se agrega metanol a las aguas residuales para apoyar la desnitrificación , la conversión de nitrato en nitrógeno gaseoso. Los procesos metabólicos bacterianos requieren metanol como fuente adicional de energía. En el procesamiento de residuos, el metanol se utiliza para el reciclaje solvolítico de tereftalato de polietileno . En el proceso, se recuperan etilenglicol y tereftalato de dimetilo. El metanol se usa para separar el poliestireno y el caucho de cloropreno de las mezclas de polímeros, por ejemplo, para encapsular otros polímeros como el caucho de butadieno .
El uso de metanol para transportar carbón en lechadas de carbón de metanol se ha estudiado ampliamente. En este proceso, la lechada de carbón y metanol se puede quemar directamente o el metanol se puede separar por destilación y bombear de regreso al lugar donde se extrae el carbón a través de tuberías. El metanol se utiliza como extractante en las industrias química y petrolera, por ejemplo para separar hidrocarburos aromáticos y parafínicos.
Importancia biológica
Metanol como sustrato en el metabolismo anaeróbico
El metanol no solo se descompone en dióxido de carbono con el fin de generar energía, sino que también puede servir como fuente de carbono para la construcción de componentes celulares. Este es particularmente el caso de los metanótrofos anaeróbicos que asimilan compuestos C 1 . Como regla general, el metanol se oxida primero a formaldehído y se puede convertir en carbohidratos en la ruta denominada Wood-Ljungdahl , la ruta de la serina o en la ruta del monofosfato de ribulosa .
Metanol como producto intermedio en la descomposición aeróbica del metano
El metanol se forma como un producto intermedio del metabolismo de las bacterias metanotróficas a partir de la oxidación del metano. Las bacterias metilotróficas ( Methylophilaceae ) y las levaduras, por ejemplo la levadura de panadería , también oxidan otros compuestos C 1 como el metanol y el formaldehído para la producción de energía. La degradación tiene lugar en entornos aeróbicos cercanos a los depósitos de metano.
La biodegradación aeróbica del metano tiene lugar a través de las etapas de metanol, formaldehído y formiato para formar dióxido de carbono (CO 2 ).
Lo siguiente se aplica a la reacción general:
La oxidación de metano a metanol es catalizada por la enzima metano monooxigenasa con consumo de oxígeno y dinucleótido de nicotinamida y adenina (NAD (P) H). La oxidación adicional del metanol resultante a formaldehído tiene lugar de diferentes formas dependiendo de la especie. Las bacterias gramnegativas oxidan el metanol a través de una metanol deshidrogenasa soluble en el espacio periplásmico con pirroloquinolina quinona (PQQ) como coenzima . Las bacterias metanotróficas grampositivas, como los bacilos y los actinomicetos, utilizan una deshidrogenasa citosólica dependiente de NAD (P) H. Por el contrario, las levaduras oxidan el metanol en los peroxisomas , que es catalizado por una alcohol oxidasa dependiente de FAD . Los electrones se transfieren al oxígeno, de modo que se produce peróxido de hidrógeno .
Se conocen varias vías metabólicas para la oxidación del formaldehído. El formaldehído es muy reactivo y se une , por ejemplo, como un aducto al ácido tetrahidrofólico o tetrahidrometanopterina , o alternativamente al glutatión .
Proteínas unicelulares
Se ha estudiado ampliamente un método para producir proteínas unicelulares ( proteína unicelular ) basado en metanol. Por ejemplo, las bacterias del tipo Methylophilus methylotropha se fermentan en reactores de transporte aéreo , utilizando amoníaco como fuente de nitrógeno . Esto da como resultado productos ricos en proteínas cuya composición de aminoácidos es similar a la de la harina de pescado . El uso de proteínas unicelulares a base de metanol para la alimentación animal es toxicológica y nutricionalmente inofensivo. Después de un procesamiento apropiado, las proteínas se pueden utilizar como alimento. Un proceso de ICI ya se ha aplicado a escala industrial, pero los productos no podía ser comercializado en comparación con la soja de bajo costo y productos de harina de pescado. La ventaja de utilizar metanol sobre otras fuentes de carbono es, además de su miscibilidad con el agua, el menor requerimiento de oxígeno y la menor generación de calor durante la fermentación.
Metanol deuterado
Hay tres variantes deuteradas diferentes de metanol:
- Metanol-d1 , también MeOD , en el que solo el átomo de hidrógeno del grupo hidroxilo se intercambió por deuterio
- Metanol-d3 , en el que se han reemplazado los átomos de hidrógeno del grupo metilo.
- Metanol-d4 en el que se han intercambiado todos los átomos de hidrógeno
El metanol-d4 (perdeuterometanol) se utiliza como disolvente en la espectroscopia de resonancia magnética nuclear (RMN).
toxicología
El metanol se absorbe fácilmente por inhalación , ingestión o contacto con la piel. Se distribuye rápidamente en el cuerpo a través de los fluidos corporales. Pequeñas cantidades se excretan sin cambios a través de los pulmones y los riñones.
El metabolismo y la toxicidad corresponden a los observados con etilenglicol . El metanol de materia prima es reemplazado solo por baja toxicidad ( toxicidad ). Sus productos de degradación ( metabolitos ) son tóxicos , como el formaldehído formado por ADH ( alcohol deshidrogenasa ) (ver figura a la derecha) y el ácido fórmico que se produce a partir de él . Este último en particular conduce al desarrollo de acidosis metabólica después de un período de latencia de 6 a 30 horas, que a menudo no presenta síntomas . El ácido fórmico solo se degrada muy lentamente por el metabolismo humano y, por lo tanto, se acumula en el cuerpo durante la descomposición relativamente rápida del metanol. La toxicidad del formaldehído es controvertida en el envenenamiento por metanol. Debido a la acción catalítica de la enzima aldehído deshidrogenasa, se descompone en ácido fórmico muy rápidamente, de modo que no hay acumulación de formaldehído en el cuerpo. Las dosis de 0,1 g de metanol por kg de peso corporal son peligrosas, más de 1 g por kg de peso corporal son potencialmente mortales.
Los síntomas de intoxicación por intoxicación por metanol se desarrollan en tres fases. Inmediatamente después de la ingestión de metanol, aparece una etapa narcótica , como con el etanol , pero el efecto intoxicante es menor que con el etanol. Después de la fase de latencia, se producen dolor de cabeza, debilidad, náuseas, vómitos, mareos y respiración acelerada en relación con el desarrollo de la acidosis metabólica . La tercera fase, la acidosis, se caracteriza por daño a los nervios, especialmente al nervio óptico (nervio óptico) . Las alteraciones visuales, que pueden desaparecer, son causadas inicialmente por edema en la retina . La degeneración del nervio óptico, en este caso una neuropatía óptica tóxica , conduce posteriormente a la ceguera . Este daño es irreversible. La muerte puede ocurrir como resultado de una parálisis respiratoria .
Para tratar la intoxicación por metanol, se evita la descomposición del metanol en el cuerpo humano para que no surjan subproductos tóxicos. Para ello, se pueden administrar alrededor de 0,7 g de etanol (comúnmente: alcohol) por kg de peso corporal, lo que inhibe competitivamente la degradación del metanol , ya que la enzima tiene una mayor afinidad por el etanol y por tanto lo degrada preferentemente ( especificidad de sustrato ). Para una terapia eficaz, el nivel de etanol debe mantenerse durante días en parte, según el grado de intoxicación y la condición física de la persona intoxicada. Es más eficaz tomar el inhibidor de la ADH 4-metilpirazol ( fomepizol ), que también inhibe competitivamente la descomposición del metanol. Al mismo tiempo, se puede promover la descomposición del ácido fórmico en el cuerpo administrando ácido fólico . Con el bicarbonato de sodio se opone la acidificación del cuerpo (puede acidosis ). En el caso de una intoxicación grave o enfermedades especiales como la cirrosis del hígado o similares, puede ser necesaria la hemodiálisis . El tratamiento debe continuarse hasta que el nivel de metanol en la sangre haya descendido por debajo de cierto límite.
Por el Reglamento nº 110/2008 del Parlamento Europeo y del Consejo del contenido de metanol de diversas bebidas alcohólicas en las que la Unión Europea es limitada. En el caso de un aguardiente de orujo de frutas , un contenido de metanol de 15 g · l −1 (calculado sobre el contenido de etanol puro) es el límite superior.
En casos raros, las bebidas alcohólicas pueden contener mayores cantidades de metanol como resultado de una maceración , fermentación y destilación o congelación inadecuadas . La mayoría de los casos conocidos de intoxicación por metanol, por ejemplo durante la prohibición o el escándalo del vino con metanol en 1986, se remontan al consumo de alcohol potable mezclado consciente o inconscientemente con metanol.
En 2012, la UE incluyó el metanol en el plan de acción en curso de la Comunidad ( CoRAP ) de conformidad con el Reglamento (CE) nº 1907/2006 (REACH) como parte de la evaluación de sustancias . Los efectos de la sustancia en la salud humana y el medio ambiente se reevalúan y, si es necesario, se inician medidas de seguimiento. Las razones de la absorción de metanol fueron las preocupaciones sobre el uso por parte de los consumidores , la exposición ambiental , la exposición de los trabajadores y el uso generalizado, así como los peligros derivados de una posible asignación al grupo de sustancias CMR . La reevaluación tuvo lugar a partir de 2012 y fue realizada por Polonia . Luego se publicó un informe final.
prueba
El metanol tiene un olor parecido al del alcohol. Si se mezcla metanol con bórax y se enciende, el borato de trimetilo resultante arde con una llama verde intensa. Esta reacción funciona con resultados similares, pero de color verde menos intenso, incluso con etanol con la adición de ácido sulfúrico concentrado . Es por eso que el etanol y el metanol se pueden diferenciar con esta llamada muestra de bórax.
El metanol a menudo se detecta mediante métodos de cromatografía de gases , como la detección de ionización de llama o la espectrometría de masas acoplada . Dependiendo del origen de la muestra, se concentra o se extrae previamente utilizando varios métodos. Para detectar metanol en el aire, primero se pasa sobre gel de sílice o carbón activado para adsorber y concentrar el metanol. El metanol se libera de nuevo mediante la posterior desorción térmica . En el caso de muestras líquidas, por ejemplo, para detección en combustible, la muestra se extrae primero con etilenglicol , por ejemplo , y luego se analiza mediante cromatografía de gases. La extracción con agua es posible para muestras sólidas.
Los sistemas de producción se pueden monitorear directamente durante el proceso de fabricación mediante espectroscopía infrarroja . Otro método es la oxidación del metanol con agentes oxidantes fuertes, como el permanganato de potasio , a formaldehído, que puede detectarse mediante métodos convencionales.
Ver también
literatura
- Holger Menrad, Alex König: combustibles de alcohol . Springer, Viena / Nueva York 1982, ISBN 3-211-81696-8 .
- El Ministerio Federal de Investigación y Tecnología (Ed.): Líneas de desarrollo en ingeniería automotriz y tráfico rodado . Informes de investigación de 1977 a 1985, TÜV Rheinland, Colonia.
- F. Asinger : Metanol, materia prima química y energética . Akademie-Verlag, Berlín 1987, ISBN 3-05-500341-1 .
- GA Olah, A. Goeppert, GK Surya Prakash: Más allá del petróleo y el gas: la economía del metanol. Verlag Wiley-VCH ( vista previa limitada en la búsqueda de libros de Google).
- Bernd Höhlein: Nuevas fuentes de energía para el tráfico: mezclas de metanol y alcohol. Verlag Forschungszentrum Jülich, 1991, ISBN 3-89336-068-9 .
- Libro VDI: Manual de energía: Generación, conversión y uso de energía. Springer Verlag, 2002, ISBN 3-540-41259-X .
- Klaus Weissermel , Hans-Jürgen Arpe : Química orgánica industrial: materias primas e intermedios importantes. Wiley-VCH Verlag, 2003, ISBN 3-527-30578-5 , pág.30 y siguientes.
- Martin Bertau , Heribert Offermanns, Ludolf Plass, Friedrich Schmidt, Hans-Jürgen Wernicke: Metanol: la materia prima química y energética básica del futuro: la visión actual de Asinger. Verlag Springer, 2014, ISBN 978-3-642-39708-0 .
- Karl-Heinz Hochhaus: Combustibles alternativos en el transporte marítimo. En: Schiffs-Ingenieur Journal. No. 2/2017.
enlaces web
- Efecto de aumento de octano del metanol en la gasolina (fuente Menrad, motorlexikon.de)
- Mettanol Institute, Arlington (inglés).
- Entrada al metanol . En: P. J. Linstrom, W. G. Mallard (Eds.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . Instituto Nacional de Estándares y Tecnología , Gaithersburg MD .
Evidencia individual
- ↑ Entrada sobre METHYL ALCOHOL en la base de datos CosIng de la Comisión de la UE, consultada el 28 de diciembre de 2020.
- ↑ a b c d e f g h i j k l m n o p q r s Entrada sobre metanol en la base de datos de sustancias GESTIS de la IFA , consultado el 1 de febrero de 2016. (Se requiere JavaScript)
- ^ Asociación de autores: Organikum . 19a edición. Johann Ambrosius Barth, Leipzig , Berlín , Heidelberg 1993, ISBN 3-335-00343-8 , p. 459.
- ↑ Entrada sobre metanol. En: Römpp Online . Georg Thieme Verlag, consultado el 1 de junio de 2014.
- ↑ Hans Lohninger: Inorganische Chemie: Dipolmomente (tabla) , inorganicik.chemie.vias.org, consultado el 9 de marzo de 2021.
- ↑ David R. Lide (Ed.): Manual CRC de Química y Física . 90a edición. (Versión de Internet: 2010), CRC Press / Taylor y Francis, Boca Raton, FL, Physical Constants of Organic Compounds, págs. 3-326.
- ↑ Entrada sobre metanol en el Inventario de clasificación y etiquetado de la Agencia Europea de Sustancias Químicas (ECHA), consultado el 1 de febrero de 2016. Los fabricantes o distribuidores pueden ampliar la clasificación y el etiquetado armonizados .
- ↑ Swiss Accident Insurance Fund (Suva): valores límite - valores actuales de MAK y BAT (busque 67-56-1 o metanol ), consultado el 13 de septiembre de 2019.
- ↑ David R. Lide (Ed.): Manual CRC de Química y Física . 97ª edición. (Versión de Internet: 2016), CRC Press / Taylor y Francis, Boca Raton, FL, Thermochemistry, Electrochemistry, and Solution Chemistry, págs. 5-26.
- ^ Metanol en el sitio web de Gelsenchem, consultado el 28 de febrero de 2020.
- ↑ Power to Metanol - como almacenamiento a largo plazo indispensable para la protección del clima - Solar Energy Association Germany (SFV) - energía solar, fotovoltaica, energía solar térmica, energía eólica, energía geotérmica, energía hidroeléctrica, residuos de biomasa y almacenamiento de electricidad para la transición energética. Consultado el 8 de septiembre de 2019 .
- ↑ A. Gossauer: Estructura y reactividad de biomoléculas. Verlag Wiley-VCH, p. 176 ( vista previa limitada en la búsqueda de libros de Google).
- ^ A b G. A. Olah, A. Goeppert, GK Surya Prakash: Más allá del petróleo y el gas: la economía del metanol. Verlag Wiley-VCH, 2009, ISBN 978-3-527-32422-4 .
- ↑ S. Lee: tecnología de síntesis de metanol. Prensa CRC, 1990, ISBN 0-8493-4610-X .
- ^ JR Couper, OT Beasley, WR Penney: La infraestructura de las industrias de procesos químicos: función y economía. Editorial Marcel Dekker, 2000, ISBN 0-8247-0435-5 .
- ↑ Acerca de BASF. Historia 1902-1924. (Ya no está disponible en línea.) BASF, archivado desde el original el 20 de julio de 2012 ; consultado el 6 de septiembre de 2018 .
- ↑ a b B. Höhlein, Th. Grube, P. Biedermann, H. Bielawa, G. Erdmann, L. Schlecht, G. Isenberg, R. Edinger: Methanol als Energieträger ( Memento del 13 de agosto de 2016 en Internet Archive ) (Archivo PDF; 5,5 MB). En: Escritos del Centro de Investigaciones Jülich. Serie de tecnología energética. Volumen 28, ISBN 3-89336-338-6 .
- ↑ T. Holst, A. Arneth, S. Hayward, A. Ekberg, M. Mastepanov, M. Jackowicz-Korczynski, T. Fribourg, PM Crill, K. Bäckstrand: mediciones de flujo de ecosistemas de BVOC en un humedal de alta latitud en Atmos . En: Chem. Phys. 10, 2010, págs. 1617-1634.
- ^ DJ Jacob, BD Field, Q. Li, DR Blake, J. de Gouw, Carsten Warneke, A. Hansel, A. Wisthaler, HB Singh, A. Guenther: Presupuesto global de metanol: Restricciones de las observaciones atmosféricas. En: Revista de Investigación Geofísica . Vol. 110, 2005; doi: 10.1029 / 2004JD005172 .
- ↑ CC von Dahl, M. Hävecker, R. Schlögl, IT Baldwin: Emisión de metanol provocada por Caterpillar: ¿una nueva señal en las interacciones planta-herbívoro? En: The Plant Journal . Volumen 46, 2006, págs. 948-960; doi: 10.1111 / j.1365-313X.2006.02760.x .
- ↑ a b c E. Kolb: Tecnología de los espíritus . Verlag de Behr, 2002, ISBN 3-86022-997-4 .
- ↑ Metanol: Qué tan seguros son ... (PDF) Oficinas de investigación para el monitoreo de alimentos y la salud animal de Baden-Württemberg, consultado el 6 de septiembre de 2018 .
- ↑ HG Classen, PS Elias, M. Winter: Evaluación toxicológica-higiénica de ingredientes y aditivos alimentarios. Verlag de Behr, 2001, ISBN 3-86022-806-4 .
- ^ W. Helferich, CK Winter: Toxikología alimentaria. Prensa CRC, 2000, ISBN 0-8493-2760-1 .
- ↑ L. Harvey-Smith, RJ Cohen: Descubrimiento de masers a gran escala en W3 (OH). En: Formación estelar desencadenada en un ISM turbulento. (= Actas del Simposio de la IAU. No. 237). 2006, doi: 10.1017 / S1743921307002104 .
- ↑ ES Wirström1, CM Persson1, A. Hjalmarson1, JH Black, P. Bergman1, WD Geppert, M. Hamberg, E. Vigren: Restricciones observacionales sobre la formación de metanol interestelar. En: Materia orgánica en el espacio. (= Actas del Simposio de la IAU. No. 251). 2008, doi: 10.1017 / S1743921308021406 .
- ↑ Spitzer Spectra of Protoplanetary Disks en caltech.edu
- ^ Extracto de Perspectivas globales de metanol y derivados 2000-2012. ( Recuerdo del 24 de julio de 2012 en el archivo web archive.today )
- ↑ Los petroquímicos de China están en auge. (PDF; 99 kB) Dechema eV, febrero de 2007, consultado el 6 de septiembre de 2018 .
- ↑ a b c d e f g h i F. Asinger: Metanol, materia prima química y energética . Akademie-Verlag, Berlín 1987, ISBN 3-05-500341-1 .
- ↑ La solución al 5% ( recuerdo del 29 de noviembre de 2014 en Internet Archive ) , en methanol.org, agosto de 2009.
- ^ M. Hennecke: El conocimiento de la ingeniería. Verlag Springer, Berlín 2007, ISBN 978-3-540-71851-2 .
- ↑ H. Daniel: Física: Mecánica, olas, calor . Verlag de Gruyter, 1997, ISBN 3-11-015602-4 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ a b c d e f g h i Información técnica y ficha de datos de seguridad para la manipulación de metanol ( Memento del 26 de agosto de 2011 en Internet Archive ) (archivo PDF; 578 kB)
- ↑ A. Töpel: Química y Física de la Leche: Materia Natural - Materia Prima - Alimentos . Verlag de Behr, 2004, ISBN 3-89947-131-8 , p. 65 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ L. Bergmann, T. Dorfmüller, C. Schaefer: Libro de texto de física experimental: mecánica, relatividad, calor . Verlag de Gruyter, 1998, ISBN 3-11-012870-5 ( vista previa limitada en la búsqueda de libros de Google).
- ^ S. Lee, JG Speight, SK Loyalka: Manual de tecnologías de combustibles alternativos. CRC Press, 2007, ISBN 978-0-8247-4069-6 ( vista previa limitada en la Búsqueda de libros de Google).
- ↑ NMR-002: Dispositivos de muestra y susceptibilidad magnética
- ↑ Manual de química de Lange. 10ª edición. 1967, págs. 1669-1674.
- ↑ a b c d Entrada sobre alcohol metílico (datos termoquímicos de fase condensada). En: P. J. Linstrom, W. G. Mallard (Eds.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . Instituto Nacional de Estándares y Tecnología , Gaithersburg MD, consultado el 17 de noviembre de 2019.
- ↑ Manual de química de Lange. 10ª edición. 1967, págs. 1522-1524.
- ↑ Competition Science Vision , Vol. 3, No. 25, marzo de 2000 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ D. Ambrose, CHS Sprake: Propiedades termodinámicas de los compuestos orgánicos de oxígeno. XXV. Presiones de vapor y temperaturas normales de ebullición de los alcoholes alifáticos. En: J. Chem. Thermodyn. 2, 1970, págs. 631-645.
- ↑ a b L. Pauling: La naturaleza del enlace químico. 3. Edición. Verlag Chemie, Weinheim 1973, pág. 443.
- ↑ Información técnica y guía de manipulación segura del metanol ( Memento del 16 de septiembre de 2012 en Internet Archive ) (archivo PDF; 1,6 MB)
- ↑ KJ Tauer, WN Lipscomb: Sobre las estructuras cristalinas, entropía residual y anomalía dieléctrica del metanol. En: Acta Crystallographica . 5, 1952, págs. 606-612, doi: 10.1107 / S0365110X52001696 .
- ↑ alcoholes. (PDF; 303 kB) (Ya no está disponible en línea.) Www.uni-tuebingen.de, archivado desde el original el 26 de junio de 2013 ; Consultado el 10 de enero de 2010 .
- ↑ EV Ivash, DM Dennison: Journal of Chemical Physics 21, 1953, p 1804th
- ↑ S. Hauptmann: Reacción y mecanismo en química orgánica. Verlag Teubner, p. 61 ( vista previa limitada en la búsqueda de libros de Google).
- ^ Klaus Weissermel, Hans-Jürgen Arpe: Química orgánica industrial: materias primas e intermedios importantes. Wiley-VCH Verlag, 2003, ISBN 3-527-30578-5 .
- ↑ GW Becker, D. Braun, L. Bottenbruch: Kunststoffhandbuch. 11 volúmenes en 17 partes, vol. 3/1, termoplásticos técnicos. BD 3 / Parte 1, Verlag Hanser Fachbuch, 1992, ISBN 3-446-16368-9 .
- ↑ J. Buddrus: Fundamentos de la química orgánica. Verlag Gruyter, 2011, ISBN 978-3-11-024894-4 .
- ↑ a b c d e http://www.methanol.org/Methanol-Basics/Resources/MMSA-Global-Methanol-Supply-and-Demand.aspx (enlace no disponible)
- ↑ Rectisol Process ( Memento del 16 de junio de 2012 en Internet Archive )
- ↑ ICIS : Usos de formaldehído y datos de mercado
- ↑ Formaldehído ( Memento del 27 de agosto de 2013 en Internet Archive ), de MMSA.
- ^ Usos de formaldehído y datos de mercado. ICIS , consultado el 9 de enero de 2010 .
- ↑ A. Behr : Intermedios alifáticos. En: Roland Dittmeyer, Wilhelm Keim , Gerhard Kreysa , Alfred Oberholz (eds.): Winnacker, Küchler. Ingeniería química: Procesos y productos Volumen 5: Compuestos orgánicos intermedios, polímeros. WILEY-VCH Verlag, Weinheim, ISBN 3-527-30770-2 .
- ↑ a b W.Keim , A. Behr, G. Schmitt: Fundamentos de la química industrial: techn. Productos y procesos. 1ª edición. Salle, Frankfurt / Berlín / Munich 1986, ISBN 3-7935-5490-2 (Sauerländer, ISBN 3-7941-2553-3 ).
- ↑ Una investigación de la viabilidad del metanol a base de carbón para su aplicación en sistemas de celdas de combustible de transporte ( Memento del 3 de febrero de 2013 en el Archivo de Internet ) (archivo PDF; 766 kB)
- ↑ Power to Metanol - como almacenamiento a largo plazo indispensable para la protección del clima - Solar Energy Association Germany (SFV) - energía solar, fotovoltaica, energía solar térmica, energía eólica, energía geotérmica, energía hidroeléctrica, residuos de biomasa y almacenamiento de electricidad para la transición energética. Consultado el 8 de septiembre de 2019 .
- ^ Athanasios A. Tountas, Xinyue Peng, Alexandra V. Tavasoli, Paul N. Duchesne, Thomas L. Dingle: Hacia el metanol solar: pasado, presente y futuro . En: Ciencia avanzada . cinta 6 , no. 8 , 2019, ISSN 2198-3844 , pág. 1801903 , doi : 10.1002 / advs.201801903 , PMID 31016111 , PMC 6468977 (texto completo gratuito).
- ↑ Descripción general del uso de metanol en combustibles para cohetes y aviones
- ↑ Tom B. Reed, RM Lerner: Metanol: un combustible versátil para uso inmediato. En: Ciencia . 182.4119, 1973, págs. 1299-1304; doi: 10.1126 / science.182.4119.1299 .
- ↑ combustible de alcohol , umweltlexikon-online.de
- ↑ ALIMENTADO POR METANOL
- ↑ H. Heitland: Alternativas en el tráfico: valoración de sus posibilidades y riesgos mediante modelos de simulación de PC. Verlag Frank Timme, p. 65 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ Inst. Francais Du Petrole (Ed.): VII. Simposio internacional sobre combustibles alcohólicos. Editions Technip, ISBN 2-7108-0517-0 , p. 277 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ S. Geitmann: Energías renovables y combustibles alternativos. Con nueva energía hacia el futuro. Verlag Hydrogeit, 2005, ISBN 3-937863-05-2 .
- ↑ JJ Romm: El boom del hidrógeno: deseo y realidad en la carrera por la protección del clima. Wiley-VCH Verlag, 2006, ISBN 3-527-31570-5 .
- ↑ B. Aldrich: ABC's of Afv's: A Guide to Alternative Fuel Vehicles. Diane Pub, 1995, ISBN 0-7881-4593-2 ( vista previa limitada en la Búsqueda de libros de Google).
- ↑ M. Trzesniowski: tecnología de autos de carreras: conceptos básicos, construcción, componentes, sistemas. Editorial Vieweg + Teubner, 2008, ISBN 978-3-8348-0484-6 .
- ↑ Ulrike Schramm: SFC Energy y Beijing Green Century Technologies firman un acuerdo de asociación para las celdas de combustible EFOY Pro en China. En: Inversores, nota de prensa. SFC Energy AG, 24 de abril de 2018, consultado el 18 de mayo de 2018 .
- ↑ Hoja informativa n. ° 3 de MTBE Uso y distribución de MTBE y etanol (archivo PDF; 20 kB)
- ↑ Capacidades de producción de biodiesel en Alemania
- ↑ K. Liu, C. Song, V. Subramani: El hidrógeno y el gas de síntesis Producción y purificación Tecnologías: Hydrocarbon Processing para H 2 Producción. Verlag John Wiley & Sons, 2010, ISBN 978-0-471-71975-5 , p. 510 y siguientes.
- ↑ Siempre que R. Błaszkowski, Rutger A. van Santen: Estudio teórico de la formación de enlaces CC en el proceso de metanol a gasolina. (Archivo PDF; 222 kB). En: J. Am. Chem. Soc. 119, 1997, págs. 5020-5027; doi: 10.1021 / ja963530x .
- ↑ Michael Seiler, Udo Schenk, Michael Hunger: Conversión de metanol a hidrocarburos en zeolita HZSM-5 investigada por espectroscopía MAS NMR in situ en condiciones de flujo y cromatografía de gases en línea. En: Catalysis Letters . 62, 1999, págs. 139-145; doi: 10.1023 / A: 1019086603511 .
- ↑ ThyssenKrupp Base: Methanol ( Memento del 8 de julio de 2012 en el archivo web archive.today )
- ↑ MTBE en combustibles , de EPA.gov.
- ↑ MTBE Ban en California (archivo PDF; 674 kB), de GAO.gov.
- ↑ Relevancia ambiental de la sustancia metil terc butil éter (MTBE) con especial consideración de la protección del agua , de Umweltbundesamt.de.
- ↑ a b Informe de progreso técnico anual para el proyecto titulado "Impacto de las propiedades de la mezcla de combustible DME-diesel en los sistemas de inyección de combustible diesel" 16 de mayo de 2003 .
- ↑ Patente US4341069 : Método para generar energía bajo demanda.
- ↑ Medio ambiente, energía y transporte (archivo PDF; 1,1 MB) Resultados de la investigación de la UE en el campo del transporte urbano y regional.
- ^ DME, combustible limpio para el transporte , en la Asociación internacional de DME.
- ↑ BioDME. BioDME, consultado el 6 de septiembre de 2018 .
- ↑ Patente US5264553 : Método para formar esferas poliméricas uniformes, partículas compuestas y partículas encapsuladas en polímero.
- ↑ BEA Jacobs: Diseño de sistemas de transporte de purines. Verlag Elsevier, p. 254 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ Proceso de separación de hidrocarburos aromáticos de mezclas ( Memento del 28 de enero de 2012 en Internet Archive ) (archivo PDF; 424 kB).
- ↑ http://www.eawag.ch/about/haben/homepages/buergmhe/Stoffwechsel08/Stoffwechsel_Termin_6-2009.pdf (enlace no disponible).
- ↑ H. Kloosterman, JW Vrijbloed, L. Dijkhuizen (2002): Caracterización molecular, bioquímica y funcional de una proteína Nudix hidrolasa que estimula la actividad de una nicotinoproteína alcohol deshidrogenasa. En: J Biol Chem . 277 (38), págs. 34785-34792. PMID 12089158 ; PDF (acceso gratuito a texto completo).
- ↑ Georg Fuchs (Ed.), Hans. G. Schlegel (Autor): Microbiología general. 8ª edición. Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-444608-1 , pág.311 .
- ↑ Cleanthis J. Israelidis: Nutrición - Proteína unicelular , veinte años después. (Ya no está disponible en línea.) Www.biopolitics.gr, archivado desde el original el 7 de octubre de 2011 ; consultado el 6 de septiembre de 2018 .
- ↑ Identificadores externos o enlaces a bases de datos para metanol-d1 : Número CAS:1455-13-6 , número CE: 215-933-0, ECHA InfoCard: 100.014.485 , PubChem : 123113 , ChemSpider : 109729 , Wikidata : Q82908334 .
- ↑ Identificadores externos o enlaces a bases de datos para metanol-d3 : Número CAS:1849-29-2 , número CE: 217-435-9, ECHA InfoCard: 100.015.851 , PubChem : 123132 , ChemSpider : 109747 , Wikidata : Q83041789 .
- ↑ Identificadores externos o enlaces a bases de datos para metanol-d4 : Número CAS:811-98-3 , número CE: 212-378-6, ECHA InfoCard: 100.011.253 , PubChem : 71568 , ChemSpider : 64640 , Wikidata : Q1100804 .
- ↑ R. Kavet, KM Nauss: La toxicidad del metanol de vapores inhalados. (Archivo PDF; 2,2 MB). En: Revisiones críticas en toxicología . 1990.
- ^ GF Fuhrmann: Toxicología para científicos naturales. Vieweg + Teubner Verlag, 2006, ISBN 3-8351-0024-6 , pág.269 .
- ^ B. Madea, B. Brinkmann: Manual de medicina judicial, Volumen 2. Verlag Springer, ISBN 3-540-66447-5 , p. 523 ( vista previa limitada en la búsqueda de libros de Google).
- ^ PU Fechner, KD Teichmann: Terapia ocular medicinal : conceptos básicos y práctica. Georg Thieme Verlag, 2000, ISBN 3-13-117924-4 , págs. 516-517.
- ↑ Intoxicación por metanol - Terapia eficaz con formepizol - GFI
- ↑ Reglamento (CE) n. ° 110/2008 del Parlamento Europeo y del Consejo, de 15 de enero de 2008, sobre la definición, descripción, presentación y etiquetado de bebidas espirituosas y la protección de las indicaciones geográficas de las bebidas espirituosas y la derogación del Reglamento (CEE) n. 1576/89
- ↑ Stuart A. Schneck: Metil, alcohol. (Archivo PDF; 763 kB). En: Manual de neurofisiología clínica. Vol. 36, 1979, págs. 351-360.
- ↑ Vino: idea asombrosa . En: Der Spiegel . No. 16 , 1986, págs. 130-132 (en línea , 14 de abril de 1986 ).
- ^ Agencia Europea de Sustancias Químicas (ECHA): Informe de evaluación de sustancias y documento de conclusión .
- ↑ Plan de acción móvil comunitario ( CoRAP ) de la Agencia Europea de Sustancias Químicas (ECHA): Metanol , consultado el 26 de marzo de 2019.
- ↑ G. Blumenthal, D. Linke, S. Vieth: Química: Conocimientos básicos para ingenieros. Editorial Vieweg + Teubner, 2006, ISBN 3-519-03551-0 , p. 242.
- ^ PJ Baugh: cromatografía de gases: una representación orientada al usuario . Publisher Vieweg ( vista previa limitada en la Búsqueda de libros de Google).
- ↑ Propiedades químicas del metanol ( Memento del 10 de marzo de 2010 en Internet Archive )