cobre
| propiedades | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Generalmente | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre , símbolo , número atómico | Cobre, Cu, 29 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría de elemento | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo , período , bloque | 11 , 4 , d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mirar | marrón rojizo, metálico, cobrizo | |||||||||||||||||||||||||||||||||||||||||||||||||||
| número CAS | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CE | 231-159-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Tarjeta de información ECHA | 100.028.326 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Fracción de masa de la envoltura terrestre | 0,01% | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómico | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomica | 63.546 (3) u | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calculado) | 135 (145) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 132 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de Van der Waals | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electronica | [ Ar ] 3 d 10 4 s 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Energía de ionización | Séptimo.726 380 (4) eV ≈ 745.48 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Energía de ionización | Vigésimo.29239 (6) eV ≈ 1 957.92 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Energía de ionización | 36.841 (12) eV ≈ 3 554.6 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Energía de ionización | 57.38 (5) eV ≈ 5 536 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Energía de ionización | 79.8 (7) eV ≈ 7 700 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Físicamente | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado fisico | firmemente | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Centrado en área cúbica | |||||||||||||||||||||||||||||||||||||||||||||||||||
| densidad | 8,92 g / cm³ (20 ° C ) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | diamagnético ( Χ m = −9,6 10 −6 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1357,77 K (1084,62 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de ebullición | 2868 K (2595 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 7.11 · 10 −6 m 3 · mol −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de evaporación | 305 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 13,3 kJ mol −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 3570 m s −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica específica | 385 J kg −1 K −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Función del trabajo | 4,65 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 58,1 · 10 6 A · V −1 · m −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 400 W m −1 K −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mecánicamente | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de elasticidad | 100… 130 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de Poisson | 0,34 ... 0,35 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Químicamente | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 1, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Potencial normal | 0,340 V (Cu 2+ + 2 e - → Cu) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1.9 ( escala de Pauling ) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Para otros isótopos, consulte la lista de isótopos. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades de RMN | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| las instrucciones de seguridad | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Suiza: 0,1 mg m −3 (medido como polvo inhalable ) |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
En la medida de lo posible y habitual, se utilizan unidades SI . A menos que se indique lo contrario, los datos proporcionados se aplican a condiciones estándar . | ||||||||||||||||||||||||||||||||||||||||||||||||||||
El cobre ( latín Cuprum ) es un elemento químico con el símbolo del elemento Cu y el número atómico 29. Es un metal de transición , en la tabla periódica está en el cuarto período y el primer subgrupo (después del nuevo grupo de conteo 11) o cobre. grupo . El nombre latino cuprum se deriva de (aes) cyprium " mineral de la isla griega de Chipre ", donde se extraía cobre en la antigüedad.
Como metal relativamente blando, el cobre es resistente y fácil de moldear. Se utiliza de muchas formas como excelente conductor de calor y electricidad . Además, también pertenece al grupo de las monedas .
Como tecnología importante o metal funcional, el cobre es un metal semiprecioso .
historia

El cobre, el oro , la plata y el estaño fueron los primeros metales que la humanidad conoció en su desarrollo. Debido a que el cobre es fácil de trabajar, fue utilizado por las culturas más antiguas conocidas hace unos 10.000 años. El momento de su uso generalizado desde el quinto milenio antes de Cristo. Hasta el tercer milenio antes de Cristo BC también se llama Edad del Cobre , según la región . En Hujayrat al-Ghuzlan en Jordania ya había alrededor del 4000 a. C. Un sitio de producción masiva de cobre. En alquimia , el cobre se asoció con Venus y la feminidad ♀ ( metales planetarios ) y se veía como un compuesto de azufre y mercurio. Los primeros espejos se fabricaron con este metal. A finales de la Edad del Bronce del Mediterráneo Oriental , el cobre se extraía principalmente en Chipre y desde allí se exportaba en barras de cobre pesadas de aproximadamente 30 kg en forma de pieles de ganado (las llamadas barras de piel de buey ). Fragmentos de barras de cuero de buey chipriota de los siglos XVI al XI a.C. BC se puede encontrar en gran parte del área mediterránea, hasta Cerdeña, en los Balcanes e incluso al norte de los Alpes ( depósito encontrado en Oberwilflingen ). El mayor productor de cobre preindustrial fue el Imperio Romano con una producción anual estimada de 15.000 t.
Posteriormente, el cobre se aleó con estaño y plomo para formar bronce . Esta aleación más dura y técnicamente más resistente dio su nombre a la Edad del Bronce . La distinción entre plomo y estaño solo se introdujo con un conocimiento cada vez mayor de los metales, por lo que desde la perspectiva actual el término bronce solo se aplica correctamente a las aleaciones de estaño-cobre con un alto contenido de cobre.
El " latón " de aleación de cobre y zinc de color amarillo dorado ya era conocido en la antigua Grecia . Se fundió procesando los respectivos minerales juntos, pero no fue hasta los romanos que este proceso se utilizó cada vez más. La aleación de oro y cobre Tumbaga fue ampliamente utilizada en la antigua Colombia .
Cobre como mineral
Las apariciones naturales de cobre nativo, es decir, en su forma elemental, se conocían mucho antes de que se fundara la Asociación Mineralógica Internacional (IMA). Por lo tanto, el cobre se reconoce como un mineral denominado con derechos adquiridos como un tipo de mineral independiente.
Según la sistemática de minerales según Strunz (9ª edición) , el cobre se clasifica en el sistema no. "1.AA.05" (elementos - metales y compuestos intermetálicos - familia de la cupalita de cobre - grupo del cobre) o en la octava edición obsoleta clasificada en I / A.01 ( serie de cobre ). La sistemática de minerales según Dana , que se utiliza principalmente en países de habla inglesa , enumera el elemento mineral en el sistema no. 01/01/01/03 ( grupo oro ).
En la naturaleza, el cobre se forma generalmente en lavas basálticas, ya sea en forma de pepitas metálicas brillantes de color rojo cobre (solidificadas a partir de la masa fundida) o en estructuras ramificadas, las llamadas dendritas . Ocasionalmente, también se puede encontrar formación cristalina. El cobre se presenta en paragénesis con varios minerales de cobre , en su mayoría secundarios , como bornita , calcosina , cornwallita , cuprita , azurita y malaquita , así como tenorita , pero también se puede asociar con muchos otros minerales como calcita , clinoclasa , prehnita , pumpellyita , cuarzo y la plata .
Pseudomorfismo de cobre a aragonito
Los minerales de cobre son comunes. Por ejemplo, el cobre está hecho de calcopirita ( pirita de cobre , CuFeS 2 ), calcosina ( brillo de cobre , Cu 2 S), más raramente también de bornita ( guijarros de cobre coloreados , Cu 5 FeS 4 ), atacamita (CuCl 2 Cu (OH) 2 ), malaquita (Cu 2 [(OH) 2 | CO 3 ]) y otros minerales. En 2019, se conocieron 636 minerales de cobre . Los minerales con mayor concentración de cobre en el compuesto son cuprita (hasta 88,8%) y algodonita (hasta 83,6%) así como paramelaconita , tenorita y calcosina (hasta 79,9%).
Ocurrencia y extracción
Según el Instituto Alemán del Cobre, el cobre se encuentra en la tierra con un contenido de alrededor del 0,006% y ocupa el lugar 23 en cuanto a la frecuencia de los elementos en la corteza terrestre . A menudo, el cobre se presenta en forma sólida , es decir, en forma elemental. En todo el mundo (a partir de 2017) hay actualmente (a partir de 2017) más de 3000 ubicaciones conocidas por el cobre sólido, incluso en Afganistán , Argentina , Australia , Bélgica , Bolivia , Brasil , Bulgaria , Chile , China , la República Democrática del Congo , Alemania. , Finlandia , Francia , Grecia , India , Irán , Irlanda , Italia , Japón , Canadá , Kazajstán , Marruecos , México , Mongolia , Namibia , Nueva Zelanda , Noruega , Austria , Perú , Filipinas , Polonia , Portugal , Rumanía , Rusia , Zambia , Suecia , Suiza , Zimbabwe , Eslovaquia , España , Sudáfrica , República Checa , Turquía , Ucrania , Hungría , Estados Unidos de América (EE. UU.) Y Reino Unido (Reino Unido).
También se pudo detectar cobre sólido en varias muestras de rocas de la cordillera del Atlántico medio y de la luna , que la sonda de la misión Luna 24 trajo del Mare Crisium .
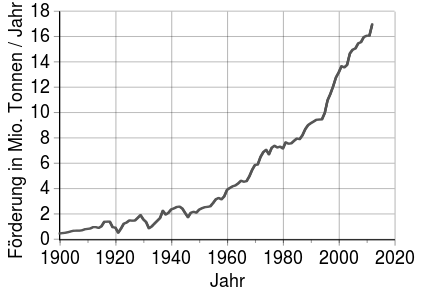
Promoción y reservas
El productor de cobre más importante es Chile, seguido de lejos por Perú y China. En Europa destacan Polonia , Portugal y Suecia . Los países exportadores más importantes se organizaron en el CIPEC desde 1967 hasta 1988 . El CIPEC incluyó a Chile, Perú y Papúa Nueva Guinea , en cuya isla Bougainville una de las minas de cobre más grandes del mundo condujo a una guerra civil en 1988.
Las minas de cobre en la península de Keweenaw en el lago Superior (EE. UU.) Fueron históricamente significativas . Allí estaba el depósito de cobre nativo más grande del mundo. La minería tuvo lugar allí en la época precolombina. En Alemania, la lutita de cobre se extraía en la región de Mansfeld hasta 1990 . Otros sitios mineros históricos fueron Kupferberg / Alta Franconia (del siglo XIII) y Kupferberg / Riesengebirge de Baja Silesia (desde el siglo XII). En Cornualles (Inglaterra) hubo una importante extracción de cobre, especialmente en los siglos XVIII y XIX.
Según el Grupo de Estudio Internacional del Cobre ICSG, según el Servicio Geológico de los Estados Unidos (USGS), las reservas de cobre actualmente rondan los 870 millones de toneladas (Mt). Los recursos de cobre identificados y no descubiertos se estiman en aproximadamente 2,100 Mt y 3,500 Mt respectivamente para un total de 5,600 Mt. Este último no tiene en cuenta las enormes cantidades de cobre que se encuentran en los nódulos de aguas profundas y los sulfuros masivos terrestres y submarinos.
| rango | país | avance | Reservas |
|---|---|---|---|
| 1 | Chile | 5800 | 170.000 |
| 2 | Perú | 2400 | 83.000 |
| 3 | República Popular de China | 1600 | 26.000 |
| Cuarto | Estados Unidos | 1200 | 48.000 |
| 5 | República Democrática del Congo | 1200 | 20.000 |
| Sexto | Australia | 950 | 88.000 |
| Séptimo | Zambia | 870 | 19.000 |
| Octavo | Indonesia | 780 | 51.000 |
| 9 | México | 760 | 50.000 |
| 10 | Rusia | 710 | 61.000 |
Extracción
Cobre crudo
Los hornos más importantes para la extracción de cobre son el horno de llama y, desde 1980, la fundición flash .
Para la producción de cobre, la llamada piedra de cobre (Cu 2 S con diferentes contenidos de FeS y un contenido de Cu de aproximadamente el 70%) se extrae primero de las piritas de cobre (CuFeS 2 ) . Para ello, la materia prima se tuesta con la adición de coque y los óxidos de hierro contenidos se escoria con agregados que contienen sílice . Esta escoria de silicato de hierro flota sobre la piedra de cobre y, por lo tanto, se puede verter fácilmente.
- Trabajo de tostado:
- Trabajo de fusión:
La piedra de cobre obtenida de esta manera se procesa en cobre crudo (también conocido como cobre negro ). Para hacer esto, se vierte en un convertidor y se sopla aire en esta masa fundida. En una primera etapa (burbujas de escoria) , el sulfuro de hierro contenido en él se tuesta en óxido de hierro y este se une mediante cuarzo escoriado para formar escoria, que se puede verter. En un segundo paso (burbujas de cocción) , dos tercios del Cu 2 S restante se oxidan a Cu 2 O. El óxido luego reacciona con el sulfuro restante para formar cobre crudo.
- Burbujas de escoria:
- Cocinar burbujas:
El cobre crudo tiene un contenido de cobre del 98%. Además de los metales básicos como el hierro y el zinc, el 2% restante también contiene metales preciosos como la plata y el oro.
Refinando
El refinado electrolítico del cobre se realiza en una solución de sulfato de cobre (II) que contiene ácido sulfúrico con un ánodo de cobre crudo y un cátodo de cobre puro . Durante la electrólisis, todos los metales que son menos nobles que el cobre se oxidan y se disuelven como cationes , mientras que los metales más nobles se hunden como lodos anódicos .
Ecuación de reacción del refino electrolítico:
- ánodo
- cátodo
Mientras que el ánodo se disuelve lentamente con la formación de cationes, solo el cobre, el cobre electrolítico, con una fracción de masa de w (Cu) = 99,99% se deposita sobre el cátodo debido a la reducción de los iones de cobre .
El lodo anódico que se crea como subproducto se recicla posteriormente y sirve como material de partida para la extracción de metales preciosos.
El cobre se extrae en refinerías . En Europa, Aurubis AG (anteriormente Norddeutsche Affinerie) con su sede en Hamburgo es conocida por esto, y solía ser Duisburger Kupferhütte (hoy DK Recycling und Pig iron ).
El cobre también se puede obtener como el llamado cobre de cemento por precipitación a partir de una solución de sulfato de cobre con hierro . El proceso de precipitación se llama cementación . El cobre obtenido suele estar contaminado. La precipitación de cobre sobre hierro a partir de soluciones de sales metálicas de origen natural se ha practicado en China desde 1086 d.C.
El cobre también se puede representar mediante una reacción aluminotérmica . Como termita se utiliza una mezcla de óxido de cobre (II) y arena de aluminio . Al usar un superplastificante (por ejemplo, fluoruro de calcio ), se puede aumentar el rendimiento porque los metales elementales, en contraste con la escoria resultante, no pueden disolverse en el superplastificante. La extracción aluminotérmica no es económica por el aluminio que requiere.
propiedades
La buena conductividad eléctrica y térmica son propiedades importantes del cobre como material. La gran importancia de este material para la tecnología surge de la combinación de varias buenas propiedades que, también en relación con otros metales en forma de aleaciones de cobre, se han utilizado y desarrollado durante años. Además, el cobre tiene una excelente resistencia a la corrosión y es 100% reciclable sin pérdida de calidad.
Propiedades físicas

Debido a su densidad de 8920 kg / m³, el cobre es uno de los metales pesados , que cristaliza en forma cúbica centrada en las caras y por lo tanto tiene un empaquetamiento cúbico más cercano de esferas con el grupo espacial Fm 3 m (grupo espacial no. 225) . El parámetro de red para el cobre puro es 0.3615 nm (corresponde a 3.615 Å ) con 4 unidades de fórmula por celda unitaria .
El cobre es un muy buen conductor de calor . Su punto de fusión es de 1083,4 ° C. El cobre también es un muy buen conductor eléctrico con una conductividad eléctrica de 58 · 10 6 S / m. Su conductividad es solo un poco peor que la de la plata y significativamente mejor que la del oro . Dado que todos los aditivos disueltos en el cobre, especialmente las impurezas como el fósforo y el hierro, reducen en gran medida la conductividad, a menudo se utilizan los grados más altos de pureza para los materiales conductores ( Cu-ETP , anteriormente E-cobre, 99,9% de pureza).
La dureza de Mohs del cobre es de 2.5 a 3, lo que corresponde a una dureza Vickers (VHN) de 77-99 con una fuerza de prueba de 1N. Por conformado en frío, que es una resistencia a la tracción de 150 a 200 MPa (blanda) aumentada a> 350 MPa. El alargamiento a la rotura se reduce por debajo del 5% con valores de dureza en torno a 100 HB . La conductividad cae. El cobre deformado y luego recocido blando tiene un alargamiento a la rotura> 40% y valores de dureza alrededor de 50 HB.
La suavidad del cobre explica en parte su alta conductividad eléctrica y alta conductividad térmica , que es la segunda más alta entre los metales puros a temperatura ambiente después de la plata . Esto se debe a que la resistividad para el transporte de electrones en metales a temperatura ambiente se basa principalmente en la dispersión de electrones durante las vibraciones térmicas de la red , que son relativamente débiles en un metal blando .
La forja es muy posible a temperaturas de 700 a 800 ° C. El conformado en frío se puede llevar a cabo sin recocido intermedio , se produce un endurecimiento por deformación .
Como metal desnudo , el cobre tiene un color rojo claro, el color de la línea es rojo rosado. El color rojo proviene del hecho de que absorbe el complementario verde y azul luz un poco más en condiciones normales de temperatura . Se empaña cuando se expone al aire e inicialmente se vuelve marrón rojizo. Con mayor desgaste y corrosión , la superficie lisa se pierde muy lentamente (a menudo durante siglos) y el color cambia de marrón rojizo a verde azulado debido a la formación de una pátina . El cobre es un material de construcción duradero con una "esperanza de vida" técnica de más de 200 años. Esta resistencia se basa en su capacidad para formar una capa protectora resistente a la intemperie y firmemente adherida en la atmósfera. Esta capa de óxido es inherentemente estable y "autocurativa". Independientemente de su composición, proporciona protección contra nuevos ataques corrosivos.
El cobre es uno de los pocos elementos metálicos con un color natural diferente al gris o al plateado. Las superficies de cobre puro son de color rojo salmón y se vuelven marrón rojizo en el aire . El color característico del cobre resulta de las transiciones entre bandas de los electrones presentes en el orbital del átomo d .
Al igual que con otros metales , la corrosión galvánica se produce cuando el cobre entra en contacto con otro metal en un electrolito . Forma elementos locales , por ejemplo, como componente traza en zinc. Sin embargo, como metal relativamente noble de la serie electroquímica , no suele verse afectado por la corrosión.
Propiedades químicas
| Estados de oxidación del cobre | |
|---|---|
| +1 | CuCl , Cu 2 O , CuH , Cu 2 C 2 |
| +2 | CuCl 2 , CuO , CuSO 4 , acetato de cobre (II) |
| +3 | KCuO 2 , K 3 CuF 6 |
| +4 | Cs 2 CuF 6 |
El cobre se presenta en los estados de oxidación 0, +1, +2, +3 y +4, los más comunes son +1 y +2, siendo +2 el estado de oxidación más estable en soluciones acuosas ; El nivel +4 es extremadamente raro (por ejemplo en Cs 2 CuF 6 ). Las sales de cobre (II) (por ejemplo, sulfato de cobre ) suelen ser de color azul o verde. En términos químicos , el cobre tiene en algunos casos propiedades similares a los elementos plata y oro, que se encuentran en el mismo grupo . Una capa de metalizado de cobre se deposita sobre un clavo de hierro que se sumerge en una solución de sulfato de cobre , para lo cual hierro va en solución como sulfato de hierro , porque el hierro es menos noble que el cobre (véase también la serie de tensión ). El cobre normalmente no es atacado por el ácido clorhídrico , pero es fuertemente atacado en presencia de oxígeno ; se disuelve con ácido sulfúrico caliente . También se disuelve en ácido nítrico y agua regia . Una mezcla de ácido clorhídrico o ácido sulfúrico con peróxido de hidrógeno disuelve el cobre muy rápidamente. El metal también es atacado por ácidos orgánicos . Contra los álcalis es estable. Al rojo vivo reacciona con el oxígeno y forma una gruesa capa de óxido de cobre . El cobre es pasivado por el flúor y sus compuestos . Dependiendo del tamaño de grano , el polvo de cobre es inflamable o combustible . El metal en forma compacta no es combustible y, después de formar una fina capa de óxido de aire y agua no se ataca, por lo que es contra el aire limpio y resistente al agua .
En el cobre líquido se disuelven oxígeno e hidrógeno , que en la solidificación de la masa fundida a vapor de agua se pueden implementar y por lo tanto la causa de la porosidad del gas en la forma de fundición .
Las grietas y cavidades pueden ocurrir en los grados de cobre que contienen oxígeno cuando entran en contacto con gases que contienen hidrógeno , lo que conduce a lo que se conoce como fragilización por hidrógeno en el cobre .
Propiedades biologicas
Para el organismo humano, el cobre es un oligoelemento esencial , es decir, los humanos necesitan cobre para sobrevivir. El requerimiento diario de alrededor de 2 mg para un adulto generalmente se logra con una dieta balanceada con una gran proporción de granos, carne, tubérculos, legumbres, nueces o incluso chocolate. El cobre es un elemento natural que se puede encontrar en diversas formas y concentraciones en la corteza terrestre, océanos, lagos y ríos. La vida de la flora y la fauna ha evolucionado en el marco de esta presencia natural del cobre. Por tanto, la mayoría de los organismos tienen un mecanismo intrínseco para su uso.
Propiedades antimicrobianas
El cobre es tóxico para muchos microorganismos (virus, gérmenes) incluso en bajas concentraciones. Debido a la propiedad antimicrobiana del cobre, el material es z. B. utilizado en experimentos a gran escala en hospitales. Un estudio clínico de 2008/2009 muestra que en la Clínica Asklepios Wandsbek , Hamburgo, después de reemplazar 50 manijas / placas de puertas e interruptores de luz, los gérmenes de MRSA se redujeron al 63%. Un estudio de Chile encontró una reducción en la cantidad de gérmenes en objetos hechos de aleaciones de cobre hasta en un 92% a una humedad de 7.2 a 19.7%. Un estudio multicéntrico de 2010/2011 de EE. UU. Muestra que la tasa de infección en las "salas de cobre" se reduce en casi un 60% y la cantidad de gérmenes en los objetos de cobre se ha reducido en más del 80%. En 2013, la Clínica de Medicina Pediátrica y Adolescente de la Clínica Niederberg en Renania del Norte-Westfalia cambió sus manijas de las puertas por manijas de aleación de cobre. Se requieren aleaciones con más del 60% de cobre. En EE. UU. Se están realizando más ensayos con diversas aplicaciones de cobre.
Los experimentos sugieren que la muerte por contacto se produce por un mecanismo en el que el contacto entre las bacterias y el metal daña la envoltura celular, lo que a su vez hace que las células sean susceptibles de sufrir más daños por el cobre. Actualmente hay tres experimentos del grupo de trabajo en la estación espacial ISS y algunos más seguirán.
El efecto reductor de gérmenes surge del hecho de que los iones de cobre se unen a los grupos tiol de las proteínas y peroxidan los lípidos de la membrana celular , lo que conduce a la formación de radicales libres que dañan el ADN y las membranas celulares. En los humanos, por ejemplo, en el caso de la enfermedad de Wilson (enfermedad por almacenamiento de cobre), esto conduce a daños en los órganos con un alto exceso de cobre.
Las aleaciones de cobre con un contenido de cobre de al menos el 60% también muestran un efecto tóxico contra los norovirus .
Efecto contra los caracoles
El cobre en el alambre de cobre o la lámina de cobre, que sirve como barrera para las plantas en peligro de extinción, es oxidado por la baba de caracol. Esto crea una sustancia irritante que evita que el caracol se arrastre más.
Demanda biológica de cobre
Dado que el cobre es particularmente importante para el metabolismo, una deficiencia de cobre puede provocar graves problemas de salud. Los beneficios para la salud del cobre son numerosos, porque el cobre influye en muchas funciones corporales como componente de enzimas y proteínas vitales: el cobre es esencial para el crecimiento de los bebés, la fuerza ósea, la maduración de los glóbulos rojos y blancos, el transporte de hierro, el colesterol y la glucosa. el metabolismo, la contracción del músculo cardíaco y el desarrollo del cerebro.
El requerimiento diario de un adulto es de 1.0 a 1.5 miligramos. En el cuerpo humano, el cobre se almacena principalmente en el hígado.
El cobre se encuentra principalmente en chocolate, hígado, cereales, verduras y frutos secos. La deficiencia de cobre rara vez ocurre en humanos. Una deficiencia es principalmente posible con diarrea prolongada, niños precoces, después de desnutrición prolongada o malabsorción debido a enfermedades como B. esprúe , enfermedad de Crohn o fibrosis quística . La ingestión de altas dosis de zinc , hierro o molibdato también puede provocar una disminución de los niveles de cobre en el cuerpo. La enfermedad de Menkes es un trastorno congénito poco común del metabolismo del cobre.
Exceso de cobre y envenenamiento
El exceso de cobre se libera en el sistema digestivo con la bilis para su excreción.
El sulfato de cobre (vitriolo de cobre) es un emético fuerte y, por lo tanto, se ha utilizado para tratar muchas intoxicaciones , por ejemplo, por fósforo blanco , que en este caso especial también tiene la ventaja de que el fósforo se une como fosfuro de cobre poco soluble al mismo tiempo .
En la enfermedad hereditaria rara de Wilson , la excreción de cobre se ve afectada y hay una mayor acumulación de cobre, primero en el hígado y luego, cuando éste excreta el cobre en el torrente sanguíneo, también en otros órganos. Otra enfermedad igualmente rara del metabolismo del cobre es el síndrome de Menkes . El cobre puede ser absorbido por las células, pero luego ya no se transporta de manera ordenada, por lo que algunos órganos tienen un mayor contenido de cobre, mientras que otros tienen un contenido de cobre reducido.
Cobre y enfermedad de Alzheimer
La conexión entre el cobre y el desarrollo de la enfermedad de Alzheimer se ha discutido una y otra vez . Ya en 2003, los investigadores sospecharon que el cobre ralentiza la producción de amiloide A y que una deficiencia de cobre promueve la enfermedad de Alzheimer. Sin embargo, un estudio piloto posterior con 70 pacientes con Alzheimer no pudo mostrar ningún efecto protector de una mayor ingesta de cobre, incluso si hubo una estabilización en la disminución de Abeta42 en el LCR , un marcador de enfermedad de la enfermedad de Alzheimer.
Otros estudios demostraron que el cobre podría ser perjudicial para el cerebro . Un estudio con el ionóforo PBT2 como ingrediente activo contra la enfermedad de Alzheimer mostró buenos resultados en un estudio de fase II. El ingrediente activo se une no solo al zinc , sino también al cobre y, por lo tanto, reduce la concentración de cobre en el cerebro.
Un nuevo estudio muestra que el cobre se deposita en los capilares cerebrales con una alta ingesta a largo plazo y puede dañar la barrera hematoencefálica allí . Esto dificulta la eliminación de beta-amiloide , la acumulación de la sustancia causa la enfermedad de Alzheimer .
usar


El cobre se utiliza puro o como aleación, en particular por su excelente conductividad eléctrica y térmica , pero también por su excelente procesabilidad y longevidad, en un gran número de aplicaciones y en muchas industrias diferentes como la automoción o la ingeniería mecánica. Las energías renovables son ahora también un campo de aplicación importante (palabra clave: construcción ecológica). Esto también incluye áreas como telecomunicaciones, arquitectura, energías convencionales, fontanería, calefacción, tráfico, aplicaciones marítimas, ingeniería eléctrica (por ejemplo, instalaciones eléctricas ), piezas de precisión, monedas , cubiertos , objetos de arte, instrumentos musicales y mucho más.
Si se usa en contacto con otros metales, provoca corrosión por contacto cuando se expone a la humedad .
Después de la plata, el cobre tiene la segunda conductividad eléctrica más alta de todas las sustancias, por delante del oro, y por lo tanto es a. usado para:
- líneas eléctricas , cables de puente y cables de potencia con secciones transversales pequeñas, líneas aéreas
- Pistas conductoras en placas de circuito impreso y parcialmente en circuitos integrados
- Máquinas eléctricas: bobinados de cables en transformadores , bobinas / bobinas y motores eléctricos
- Componentes: cuerpos de ánodo de magnetrones , abrazaderas , patas de conexión de componentes, soportes de contacto, manguitos de compresión
Es cierto que el aluminio es más barato y, en términos de masa por longitud, mejor conductor eléctrico que el cobre. Pero es más voluminoso. I a. Debido a esto, y también debido a que el cobre puede contactarse mejor y tiene una mayor resistencia a la fatiga por flexión, generalmente se prefiere como conductor al aluminio, excepto cuando el peso o el precio son importantes.
Los alambres y hebras de cobre sin oxígeno ( OFC , inglés para cobre sin oxígeno con una pureza> 99,99%) tienen una estructura de cristal de grano muy fino y una resistencia a la fatiga particularmente alta. Se utilizan para cables y alambres que están sujetos a una gran tensión mecánica.
Las aleaciones de cobre y magnesio se utilizan para líneas aéreas . Debe encontrarse un compromiso entre aumentar la resistencia a la tracción y disminuir la conductividad.
El cobre tiene una alta reflectividad en el rango infrarrojo y, por lo tanto, se utiliza como espejo para rayos láser de dióxido de carbono y para revestir vidrio ( vidrio aislante ).
Debido a su alta conductividad térmica y resistencia a la corrosión, es muy adecuado como material para intercambiadores de calor , disipadores de calor y placas de montaje para semiconductores de potencia . A menudo se utiliza como utensilios de cocina en gastronomía .
En artes y oficios , la hoja de cobre se impulsa , es decir, se deforma mediante martillazos, lo que es fácilmente posible debido a su suavidad. En las bellas artes, el cobre todavía se utiliza para fabricar planchas de impresión para grabados y aguafuertes sobre planchas de cobre .
Los techos también se cubren con láminas de cobre, que luego forman una pátina verdosa permanente , que consiste en varios hidróxidos de cobre básicos o carbonatos de cobre . Esta pátina, que a menudo se denomina incorrectamente "verdín" (ver acetato de cobre ), protege el metal de la parte inferior contra una mayor corrosión , de modo que los techos de cobre pueden tener una vida útil de varios siglos. Los clavos de cobre se utilizan en los techos de pizarra tradicionales . El cobre se utiliza cada vez más para cubiertas y fachadas, también por motivos estéticos.
Aleaciones
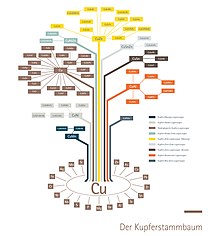
El cobre también es un componente de más de 400 aleaciones como B. latón (con zinc), bronce (con estaño) y alpaca (con zinc y níquel). Estas aleaciones de cobre se utilizan ampliamente debido a sus buenas propiedades, como el color, la resistencia a la corrosión y la procesabilidad. Se hace una distinción entre aleaciones forjadas (latón y alpaca) y materiales fundidos ( bronce , bronces): las aleaciones forjadas se llevan a la forma deseada mediante conformado de plástico (conformado en caliente: laminado, forjado, etc. o conformado en frío: trefilado, martillado, laminado en frío, embutición profunda, etc.), mientras que los materiales fundidos suelen ser difíciles o imposibles de moldear plásticamente.
Dependiendo de la adición de níquel , el color propio del cobre desaparece y se forman aleaciones resistentes a la corrosión de color amarillento a blanco ( cobre-níquel ).
Muchos materiales de monedas están hechos a base de cobre, por lo que el metal de las partes de color dorado de las monedas de euro llamadas " oro nórdico " es una aleación de cobre, zinc, aluminio y estaño. Los metales de las monedas de 1 DM válidos hasta 2001 y las partes de color claro de las monedas de euro consisten en aleaciones de cuproníquel .
Los compuestos de cobre se utilizan en pigmentos de color , como tóners , en preparaciones médicas y revestimientos de superficies galvánicas .
El árbol genealógico del cobre del Instituto Alemán del Cobre ofrece una descripción general de las diferentes familias de aleaciones.
prueba
El cobre colorea la perla de bórax en la zona de llama oxidante de azul a verde azulado, en la zona de llama reductora no se nota decoloración o la perla es de color rojo a marrón rojizo. En el proceso clásico de separación de cationes , el cobre se precipita en el grupo del sulfuro de hidrógeno y se detecta allí como un complejo azul en el grupo del cobre. El último color se basa en el hecho de que las soluciones de iones de cobre (II) con amoníaco forman un complejo de tetramina de cobre de color azul profundo, [Cu (NH 3 ) 4 ] 2+ (ver también reacción de formación de complejos ).
Una solución de hexacianoferrato de potasio (II) precipita iones de cobre (II) como hexacianoferrato de cobre (II) (II), Cu 2 [Fe (CN) 6 ]. Esta reacción de detección es muy sensible; es decir, también indica niveles bajos de cobre.
Las sales de cobre colorean la llama (llama del mechero Bunsen) de verde a azul ( color de la llama , análisis espectral ).
La determinación cuantitativa se puede realizar mediante electrogravimetría sobre un cátodo de malla de platino a partir de una solución que contiene ácido sulfúrico, cobre (II). El cobre se puede determinar dimensionalmente por yodometría o complexometría ( titulación con Titriplex / complexon III con indicador de murexido ). En el área de la pista que es Differenzpulspolarographie disponible (potencial de media onda -0,62 V frente a SCE en solución de tiocianato 1 M ). Los ultra trazas de cobre se determinan mediante voltamperometría inversa , tubo de grafito AAS o ICP-MS .
Los iones de cobre (II) forman un complejo azul con cuprizona ( bisciclohexilideno hidrazida de ácido oxálico) en una solución débilmente alcalina.
Enlaces
Óxidos e hidróxidos
El óxido de cobre (I) es rojizo y tiene una estructura cristalina cúbica con el grupo espacial Pn 3 m (grupo espacial nº 224) . Se utiliza como pigmento en vidrio , cerámica , esmalte , vidriado de porcelana y como abrillantador óptico de vidrio , insecticida , catalizador para la producción de amoníaco , solvente para minerales de hierro y cromo , en electrodos galvánicos , en pirotecnia , formación de nubes , inhibidores de corrosión , procesos de galvanización. , electrónica , textiles , como retardante de llama , aditivo de combustible, catalizador utilizado en el control de la contaminación, impresión y fotocopiado y como conservante de madera .
El óxido de cobre (II) es un sólido negro, amorfo o cristalino y forma una estructura cristalina monoclínica con el grupo espacial C 2 / c (grupo espacial nº 15) . Se utiliza en la industria cerámica para colorear vidrios , vidriados y esmaltes de azul, verde o rojo. Ocasionalmente se usa para incorporar aditivos minerales para proteger contra la deficiencia de cobre en la nutrición animal. Sus otras aplicaciones incluyen la preparación de soluciones para la industria de la celulosa.
El hidróxido de cobre (II) es azul y se utiliza para la producción de pulpa , se utilizan electrodos de batería y otras sales de cobre. Se utiliza como aderezo en teñido , como pigmento y aditivo para piensos , en el tratamiento de la pudrición por almacenamiento en arándanos y como fungicida contra puntos débiles bacterianos en lechugas, melocotones, arándanos y nueces.
Haluros
El cloruro de cobre (II) es un polvo marrón altamente higroscópico . Se utiliza como catalizador de reacciones orgánicas e inorgánicas , mordiente para teñido e estampado de textiles , pigmento para vidrio y cerámica , conservante de madera , desinfectante , insecticida , fungicida y herbicida , así como catalizador en la producción de cloro a partir de cloruro de hidrógeno utilizado. . El cloruro de cobre (II) dihidrato (CuCl 2 · 2 H 2 O) es un sólido azul verdoso .
Copper (I) cloruro es blanco y tiene una estructura cristalina de la blenda de zinc tipo con grupo espacial F 4 3 m (grupo espacial no. 216) . Se utiliza como catalizador para muchas reacciones orgánicas . Las soluciones de amoníaco de cloruro de cobre (I) se utilizan para purificar gases a partir de monóxido de carbono .
Otros compuestos inorgánicos
El sulfato de cobre se encuentra naturalmente como calcantita (sulfato de cobre pentahidratado, Cu [SO 4 ] · 5H 2 O) y como bootita (sulfato de cobre heptahidratado, Cu [SO 4 ] · 7H 2 O). Se utiliza para la conservación de pieles para el curtido de cueros , para la producción de sales de cobre, para la conservación de la pulpa y pulpa de madera molida , para combatir el crecimiento de algas en aguas estancadas . También se utiliza en soluciones de galvanoplastia , pinturas de lavado y marcado de metales, refinerías de petróleo , pirotecnia y muchas otras aplicaciones industriales .
Compuestos orgánicos

El acetato de cobre (II) (cardenillo) forma cristales de color verde oscuro . Se utiliza como fungicida , catalizador de reacciones orgánicas , pigmento para cerámica , insecticida , inhibidor de moho, conservante para materiales celulósicos , estabilizador para poliuretanos y nailon , inhibidor de corrosión y aditivo para combustibles.
Desarrollo de precios
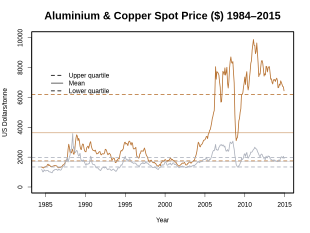
El cobre es un metal relativamente caro. Su precio se basa en gran medida en las principales bolsas de productos básicos y las bolsas de futuros de productos básicos del mundo . La Bolsa de Metales de Londres (LME) es líder en el comercio de cobre .
El precio del cobre en el mercado mundial está sujeto a fuertes fluctuaciones : experimentó una de las mayores fluctuaciones en 2008, cuando el precio del cobre en la LME aún cotizaba en el máximo interino de 8,940 USD / t el 2 de julio de 2008 y en su el nivel más alto hasta el 23 de diciembre de 2008 cayó el mínimo de 10 años de $ 2.825. Posteriormente, el precio del cobre se recuperó en menos de 4 meses al 15 de abril de 2009 a 4.860 USD / t. El precio del cobre alcanzó su máximo de 10 años el 14 de febrero de 2011 a 10.180 USD / t.
De marzo de 2012 a marzo de 2013, el precio del cobre alcanzó un pico el 2 de abril de 2012 a USD 8.619,75 y el 2 de agosto de 2012 a USD 7.288,25. También se encontró un rango similar de octubre de 2012 a marzo de 2013 entre 8.350 USD / ty 7.577 USD / t.
En agosto de 2014, el precio del cobre en el mercado mundial rondaba los 7.000 USD / t. Según el tipo de cambio de ese momento, era de 5.931 EUR / t.
El alto precio del cobre también está provocando un aumento en el robo de objetos que contienen cobre. Los cables de tierra de los ferrocarriles se ven especialmente afectados. Por ejemplo, Deutsche Bahn AG sufrió daños por alrededor de 14 millones de euros en 2015.
Uno de los mayores escándalos financieros de la historia reciente es el asunto Sumitomo . Se basó en el comercio del cobre. Como resultado del descubrimiento, el precio del cobre cayó un 27% en un día en 1996.
literatura
- Harry H. Binder: Léxico de los elementos químicos: la tabla periódica en hechos, cifras y datos. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- JW Howard: La historia del cobre . En: Revista de Educación Química . cinta 6 , no. 3 , 1929, págs. 413-431 , doi : 10.1021 / ed006p413 ( PDF ).
enlaces web
- Atlas de minerales: cobre (datos), atlas de minerales: retrato mineral / cobre (historia, fundición, etc.)
- deutschlandfunk.de , Das Feature , 18 de julio de 2017, Michael Faulmüller: Copper - Element of Discord: A Story of Eternal Struggle
- kupfer-institut.de ( Instituto Alemán del Cobre DKI)
- London Metal Exchange , lme.com: Precio del cobre
Observaciones
- ↑ Los valores de las propiedades (cuadro de información) se toman de www.webelements.com (cobre) , a menos que se indique lo contrario .
Evidencia individual
- ↑ a b Harry H. Binder: Léxico de los elementos químicos. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ^ CIAAW, Pesos atómicos estándar revisados en 2013 .
- ↑ a b c d e Entrada sobre cobre en Kramida, A., Ralchenko, Yu., Reader, J. y NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Ed.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Consultado el 11 de junio de 2020.
- ↑ a b c d e Entrada sobre el cobre en WebElements, https://www.webelements.com , consultado el 11 de junio de 2020.
- ^ NN Greenwood, A. Earnshaw: Química de los elementos. 1ª edición. VCH, Weinheim 1988, ISBN 3-527-26169-9 , pág.1509 .
- ↑ Robert C. Weast (ed.): Manual CRC de Química y Física . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , págs. E-129 a E-145. Los valores se basan en g / mol y se expresan en unidades cgs. El valor especificado aquí es el valor SI calculado a partir de él, sin una unidad de medida.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Valores corregidos para puntos de ebullición y entalpías de vaporización de elementos en manuales. En: Journal of Chemical & Engineering Data. 56, 2011, págs. 328-337, doi: 10.1021 / je1011086 .
- ^ A. Lossin: Cobre. En: Enciclopedia de química industrial de Ullmann. Wiley-VCH Verlag, Weinheim 2005, doi : 10.1002 / 14356007.a07_471 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Libro de texto de física experimental. Volumen 6: Sólidos. 2ª Edición. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , pág.361.
- ^ Buildingmaterials.de: Copper ( Memento del 15 de noviembre de 2009 en Internet Archive )
- ^ Colección de materiales de construcción de la Facultad de Arquitectura de la Universidad Técnica de Munich: Metales - Cobre .
- ↑ Glyconet ( página ya no disponible , búsqueda en archivos web ) Información: El enlace se marcó automáticamente como defectuoso. Verifique el enlace de acuerdo con las instrucciones y luego elimine este aviso. .
- ↑ a b c Entrada sobre cobre en la base de datos de sustancias GESTIS de la IFA , consultado el 25 de abril de 2017. (Se requiere JavaScript)
- ↑ Swiss Accident Insurance Fund (Suva): valores límite - valores actuales de MAK y BAT (búsqueda de cobre y sus compuestos inorgánicos ), consultado el 4 de marzo de 2020.
- ^ Wilhelm Hassenstein: El libro de fuegos artificiales de 1420. 600 años de pólvora y armería alemanas. Reimpresión de la primera edición de 1529 con traducción al alemán estándar y explicaciones, Munich 1941, p. 104.
- ↑ Sobre barras de piel de buey, su distribución y el comercio de cobre de la Edad del Bronce, ver: Serena Sabatini: Revisitando los lingotes de piel de buey de la Edad del Bronce tardía. Significados, preguntas y perspectivas. En: Ole Christian Aslaksen (Ed.): Perspectivas locales y globales sobre la movilidad en el Mediterráneo Oriental (= Artículos y monografías del Instituto Noruego de Atenas, Volumen 5). El Instituto Noruego de Atenas, Atenas 2016, ISBN 978-960-85145-5-3 , págs.15-62.
- ↑ Sungmin Hong, Jean-Pierre Candelone, Clair C. Patterson, Claude F. Boutron: Historia de la contaminación de la fundición de cobre antigua durante la época romana y medieval registrada en el hielo de Groenlandia. En: Ciencia . Volumen 272, No. 5259, 1996, págs. 246-249 (247, Fig.1 y 2; 248, Tab.1)
- ^ Lista de nombres de minerales de IMA / CNMNC; Julio de 2019 (PDF 1,67 MB; cobre ver p. 44)
- ↑ IMA / CNMNC Lista de nombres de minerales - Cobre (inglés, PDF 1.8 MB, p. 64)
- ↑ Webmineral - Minerales según la clasificación de New Dana. 01/01/01 Grupo oro
- ^ Cobre . En: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Eds.): Handbook of Mineralogy, Mineralogical Society of America . 2001 ( handbookofmineralogy.org [PDF; 58 kB ; consultado el 22 de enero de 2018]).
- ^ Atlas mineral: Cobre
- ↑ Webmineral - Especies minerales ordenadas por el elemento Cu (Cobre ).
- ↑ Instituto Alemán del Cobre - Disponibilidad de Cobre
- ↑ a b Lista de localidades de cobre sólido en Mineralienatlas y Mindat
- ↑ Springer: Kupferberg, Paul Zsolnay-Verlag, Viena, 2019.
- ↑ patrimonio mundial de Cornualles Minería ( Memento de la original, del 17 de febrero de 2011 en el Archivo de Internet ) Información: El archivo de enlace se inserta de forma automática y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso. .
- ↑ ICSG (Ed.): World Copper Fact Book 2020 .
- ↑ Servicio Geológico de Estados Unidos: Producción y reservas de minas mundiales
- ↑ Página ya no disponible , búsqueda en archivos web: cobre y sus productos .
- ↑ TN Lung: La historia de la cementación de cobre sobre hierro - El primer proceso hidrometalúrgico del mundo de la China medieval. En: Hidrometalurgia . Volumen 17, Número 1, noviembre de 1986, págs. 113-129; doi: 10.1016 / 0304-386X (86) 90025-3 .
- ^ Ralph WG Wyckoff: Estructuras de cristal . 2ª Edición. cinta 1 . John Wiley & Sons, Nueva York, Londres, Sydney 1963, págs. 3 (en el apéndice ).
- ^ Hugo Strunz , Ernest H. Nickel : Tablas mineralógicas de Strunz. Sistema de clasificación de minerales químico-estructurales . 9ª edición. E. Schweizerbart'sche Verlagbuchhandlung (Nägele y Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , pág. 34 .
- ↑ H. Keller, K. Eickhoff: Kuper and Copper Alloys, Springer-Verlag 2013, 54 páginas, página 7
- ↑ George L. Trigg, Edmund H. Immergut: Enciclopedia de física aplicada , Volumen 4: Combustión al diamagnetismo. VCH Publishers, 1992, ISBN 978-3-527-28126-8 , págs. 267-272 (consultado el 2 de mayo de 2011).
- ^ Arquitectura - Instituto Alemán del Cobre. Recuperado el 12 de julio de 2021 (alemán).
- ^ William Chambers, Robert Chambers: información de las cámaras para la gente , 5to. Edición, Volumen L, W. & R. Chambers, 1884, ISBN 978-0-665-46912-1 , p. 312.
- ^ Corrosión galvánica . En: Corrosion Doctors . Consultado el 29 de abril de 2011.
- ^ Universidad de Siegen: Reacción de metales con ácido clorhídrico .
- ↑ Hechos sobre el tema - ácido sulfúrico ( Memento del 8 de marzo de 2001 en el Archivo de Internet )
- ^ Universidad de Siegen: reacción de metales con ácido nítrico .
- ↑ Química de eLexicon: cloruro de cobre .
- ↑ Denise Herzog: La importancia del cobre en el cuerpo humano: una breve descripción . En: Revista suiza de medicina nutricional . No. 1/10 .
- ↑ Jens Oliver Bonnet: Cobre contra los gérmenes: Se superaron las expectativas. Asklepios Kliniken Hamburg GmbH, comunicado de prensa del 16 de junio de 2009 de Informationsdienst Wissenschaft (idw-online.de), consultado el 15 de septiembre de 2015.
- ↑ Cobre Germkiller - tema para "saber hasta la fecha: el poder de los piratas celulares" .
- ↑ ¿Ha llegado a la práctica clínica diaria? Materiales de construcción antimicrobianos a base de cobre sólido , en krankenhaushygiene.de
- ↑ https://www.amcopper.com/
- ↑ Salima Mathews, Michael Hans, Frank Mücklich, Marc Solioz: Se suprime la destrucción por contacto de bacterias en el cobre si se evita el contacto entre bacterias y metales y se induce en el hierro por iones de cobre . En: Microbiología aplicada y ambiental . cinta 79 , no. 8 de abril de 2013.
- ↑ A. Ala, AP Walker, K. Ashkan, JS Dooley, ML Schilsky: Enfermedad de Wilson. En: The Lancet . Volumen 369, Número 9559, febrero de 2007, págs. 397-408, doi: 10.1016 / S0140-6736 (07) 60196-2 . PMID 17276780 .
- ^ SL Warnes, CW Keevil: Inactivación de norovirus en superficies secas de aleación de cobre. En: PLoS One. 8 (9), 2013, e75017. PMID 24040380 , PMC 3767632 (texto completo gratuito, PDF).
- ↑ ratschlag24.com: Alambre de cobre contra la plaga de los caracoles. ( Recuerdo del 11 de abril de 2013 en el archivo web archive.today ) 17 de marzo de 2008.
- ↑ sat1.de: emisión 24: ¡inteligente! - Libro de conocimientos ( Memento del 26 de mayo de 2011 en Internet Archive ).
- ↑ med.de: Entry on copper , consultado el 23 de febrero de 2013.
- ↑ a b Manual de Merck: Cobre .
- ↑ JF Mercer: síndrome de Menkes y modelos animales. En: Revista estadounidense de nutrición clínica. Volumen 67, Suplemento número 5, mayo de 1998, págs. 1022S-1028S. PMID 9587146 . (Revisar).
- ↑ S. Lutsenko, NL Barnes et al.: Función y regulación de las ATPasas transportadoras de cobre humanas. En: Revisiones fisiológicas . Volumen 87, número 3, julio de 2007, págs. 1011-1046, doi: 10.1152 / physrev.00004.2006 . PMID 17615395 . (Revisar).
- ↑ TA Bayer: El Cu dietético estabiliza la actividad de la superóxido dismutasa 1 del cerebro y reduce la producción de Aβ amiloide en ratones transgénicos APP23. En: Actas de la Academia Nacional de Ciencias. 100, 2003, págs. 14187-14192, doi: 10.1073 / pnas.2332818100 .
- ↑ Holger Kessler, Frank-Gerald Pajonk , Daniela Bach, Thomas Schneider-Axmann, Peter Falkai, Wolfgang Herrmann, Gerd Multhaup, Jens Wiltfang, Stephanie Schäfer, Oliver Wirths, Thomas A. Bayer: Efecto de la ingesta de cobre en los parámetros del LCR en pacientes con enfermedad de Alzheimer leve: una fase piloto, 2 ensayo clínico. En: Journal of Neural Transmission. 115, 2008, págs. 1651-1659, doi: 10.1007 / s00702-008-0136-2 .
- ^ NG Faux, CW Ritchie, A. Gunn, A. Rembach, A. Tsatsanis, J. Bedo, J. Harrison, L. Lannfelt, K. Blennow, H. Zetterberg, M. Ingelsson, CL Masters, RE Tanzi, JL Cummings, CM Herd, AI Bush: PBT2 mejora rápidamente la cognición en la enfermedad de Alzheimer: análisis de fase II adicionales. En: Revista de la enfermedad de Alzheimer: JAD. Volumen 20, Número 2, 2010, págs. 509-516, doi: 10.3233 / JAD-2010-1390 . PMID 20164561 .
- ↑ I. Singh, AP Sagare, M. Coma, D. Perlmutter, R. Gelein, RD Bell, RJ Deane, E. Zhong, M. Parisi, J. Ciszewski, RT Kasper, R. Deane: niveles bajos de disrupción de cobre homeostasis de la β-amiloide cerebral alterando su producción y eliminación. En: Actas de la Academia Nacional de Ciencias. S., doi: 10.1073 / pnas.1302212110 .
- ↑ Deutsches Kupferinstitut: Cobre y sus aplicaciones ( Memento de la original, del 16 de julio de 2012 en el archivo web archive.today ) Información: El archivo de enlace se ha insertado de forma automática y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso. .
- ↑ Aleaciones de cobre. Consultado el 12 de julio de 2021 .
- ^ R. Neeb: Polarografía inversa y voltamperometría. Akademie-Verlag, Berlín 1969, págs. 185-188.
- ↑ a b Georg Brauer (Ed.), Con la colaboración de Marianne Baudler y otros: Manual de Química Inorgánica Preparativa. 3ª edición revisada. Volumen II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , p. 979.
- ↑ a b c d Inventario Nacional de Contaminantes: Cobre y compuestos
- ↑ Georg Brauer (Ed.), Con la colaboración de Marianne Baudler y otros: Manual de Química Inorgánica Preparativa. 3ª edición revisada. Volumen II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , p. 973.
- ↑ Líder en el comercio de cobre: London Metal Exchange - LME Copper . Consultado el 15 de marzo de 2013.
- ↑ a b c Desarrollo del precio del cobre en la Bolsa de Metales de Londres en el periodo comprendido entre el 2 julio 2008 hasta 15 abril 2009 ( Memento de la original, del 12 de agosto, 2014 en el Archivo de Internet ) Información: El archivo de enlace se inserta automáticamente y aún no comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso. Fuente: base de datos Handelsblatt. Consultado el 15 de marzo de 2013.
- ↑ Precio más alto del cobre en la Bolsa de Metales de Londres en los últimos 10 años el 14 de febrero de 2011 Fuente: Handelsblatt. Consultado el 15 de marzo de 2013.
- ↑ Evolución del precio del cobre en la Bolsa de Metales de Londres en los últimos 12 meses Fuente: Handelsblatt. Consultado el 15 de marzo de 2013.
- ↑ Evolución del precio del cobre en la Bolsa de Metales de Londres en los últimos 6 meses Fuente: Handelsblatt. Consultado el 15 de marzo de 2013.
- ↑ Precio actual para el cobre en la Bolsa de Metales de Londres ( Memento de la original, del 12 de agosto, 2014 en el Archivo de Internet ) Información: El archivo de enlace se inserta de forma automática y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso. Fuente: Handelsblatt.
- ↑ Esta cifra se determinó con la plantilla: Tipo de cambio.
- ^ Robo de metales no ferrosos en Deutsche Bahn. (Ya no está disponible en línea.) Oficina de prensa de Deutsche Bahn, archivado desde el original el 23 de diciembre de 2016 ; consultado el 22 de diciembre de 2016 .