Tintes
Los tintes son colorantes que, a diferencia de los pigmentos, son solubles en medios de aplicación como agua u otros disolventes . Se pueden clasificar según varios criterios, por ejemplo según su origen ( tintes naturales / tintes sintéticos ), su uso ( sustrato ), su estructura química ( cromóforo ) o su campo de aplicación.
Algunos tintes se pueden convertir en pigmentos insolubles mediante la adición de precipitantes , ver laking .
historia
Se sabe poco sobre el uso de tintes en la antigüedad, ya que se degradan con relativa facilidad por la acción de la luz, el aire y los microorganismos . Sin embargo, utilizando métodos analíticos modernos (por ejemplo, HPLC ), se pueden detectar los rastros más pequeños de colorantes. Fue posible detectar el tinte azul, soluble en agua, indigotina en textiles egipcios que tienen más de 3000 años . El cultivo de la planta índigo ( Indigofera tinctoria ) ya es del 2500 a. C. En Egipto hay evidencia de esto y los registros del proceso de teñido con índigo nos han llegado desde la antigüedad ( Papyrus Leidensis , Papyrus Holmiensis). En Europa, este tinte se obtuvo a partir del gofre . Este enfoque dejó de ser rentable en el siglo XVII, cuando se importaron grandes cantidades de índigo de la India oriental .

El uso del morado real , obtenido del caracol morado que se encuentra en la costa del Mediterráneo oriental , también se puede probar en la antigüedad. Para el teñido de rojo, la muy caro púrpura fue reemplazado en parte por el colorante de alizarina contenida en el madder ( Rubia tinctorum ), un colorante que ya era conocido antes del nacimiento de Cristo. Otros tintes de origen natural que se han utilizado desde la antigüedad fueron henna , kermes , cúrcuma y azafrán .
Con el "descubrimiento" de los tintes naturales estadounidenses de la madera (eran Logwood , Redwood , Yellow Wood ) en el teñido de textiles y cuero, también para el cabello y el color del papel. El uso de carmín real , obtenido de la mosca blanca de la cochinilla ( Dactylopius coccus Costa), también se ha popularizado en Europa .
La base para el desarrollo de tintes orgánicos sintéticos se estableció en la primera mitad del siglo XIX. Friedlieb Ferdinand Runge aisló y caracterizó en 1834 a partir de alquitrán de hulla , que es un subproducto de la coquización de carbón , incluyendo anilina y fenol . El primer tinte sintético fue descubierto por casualidad en 1832 por el químico alemán Karl von Reichenbach y lo llamó Pittakall . El químico August Wilhelm von Hofmann se ocupó de la química del alquitrán de hulla desde 1843 y desarrolló numerosas implementaciones y procesos nuevos. El estudiante de Hofmann, William Henry Perkin, encontró en 1856 en pruebas de oxidación la anilina Mauvein . Este fue el primer tinte sintético fabricado comercialmente. En los años siguientes, la química de las pinturas de alquitrán , especialmente a través del trabajo de Hofmann y sus estudiantes Perkin, Johann Peter Grieß , Carl Alexander von Martius (fundador de Agfa ) y Georg Merck (fundador de Merck & Co. en Nueva York ), tuvo un desarrollo tormentoso:
- 1856: Primera síntesis del tinte de trifenilmetano fucsina por el químico polaco Jakub Natanson.
- 1858: Desarrollo y patente de una producción de fucsina por el químico francés François-Emmanuel Verguin . Casi al mismo tiempo, August Wilhelm Hofmann desarrolló una síntesis alternativa de fucsina.
- 1861: Invención del cristal violeta por Charles Lauth - un tinte del grupo de tintes catiónicos , que es adecuado para tintas de impresión , tintas y papel autocopiativo .
- 1862: Desarrollo de la reacción de diazotización como un paso intermedio importante en la síntesis de colorantes azo por Johann Peter Grieß. Los tintes azoicos se convirtieron en el grupo más importante y extenso de tintes sintéticos.
- 1863: Invención del marrón Bismarck por Martius, el primer tinte azoico producido comercialmente.
- 1869: Primera síntesis de un colorante natural, la alizarina , por el químico de BASF Heinrich Caro en colaboración con Carl Graebe y Carl Liebermann .
- 1871: Desarrollo de la síntesis del indicador de pH fenolftaleína a partir de anhídrido ftálico y resorcinol por Adolf von Baeyer .
- 1877: Síntesis de verde malaquita por Otto Fischer .
- 1878: Primera síntesis completa de índigo por Adolf von Baeyer. Karl Heumann desarrolló un proceso de producción alternativo en 1890 , que, después de nuevas mejoras, condujo a la producción industrial del tinte a partir de 1897. La producción de añil industrial rentable, que se logró a través de una mayor optimización del proceso, en particular por parte del químico Johannes Pfleger , condujo en pocos años a una reducción drástica en la participación de mercado del añil obtenido de forma natural.
La exitosa producción y comercialización a gran escala de los nuevos tintes sintéticos fue importante para este desarrollo. Perkin aseguró su invención con una patente y fundó una fábrica de productos químicos en la que se producía malvena como tinte para teñir seda y algodón ya en 1857 . En Alemania, la posterior Hoechst AG (el 2 de enero de 1863 como Theerfarbenfabrik Meister, Lucius & Co. ) y Bayer AG (el 1 de agosto de 1863 como Friedr. Bayer et comp. ) Y dos años más tarde, BASF (el 6 de abril 1865 como fábrica de anilina y refrescos de Baden ).
Un mayor desarrollo de la química de los tintes en el siglo XX fue la introducción de tintes de tina resistentes a la luz basados en antraquinona . El primer representante en 1901 fue el tinte azul de indantreno desarrollado por BASF , a partir del cual se desarrolló la extensa gama de indantreno. En los años veinte, la invención de los tintes dispersos permitió teñir fibras sintéticas hidrófobas , como el acetato de seda o fibras de poliéster posteriores . Con el desarrollo de las ftalocianinas , especialmente la ftalocianina de cobre , ICI produjo un nuevo cromóforo que contenía un metal a partir de 1935 , que se utilizó inicialmente como pigmento. Al introducir grupos solubilizantes de ácido sulfónico, este cromóforo también podría usarse como colorante. En 1951 se introdujeron los primeros tintes reactivos para teñir lana y, a partir de 1956, tintes reactivos para teñir algodón. En las décadas que siguieron, el enfoque del desarrollo de tintes textiles fue mejorar las propiedades de aplicación. Por ejemplo, mediante el desarrollo de tintes reactivos bifuncionales o tintes reactivos con nuevos grupos reactivos.
Además de las aplicaciones textiles, los tintes funcionales se han centrado cada vez más en los últimos años. Este término fue acuñado en 1993 para los tintes cuya aplicación específica no se basa en sus propiedades estéticas de color. Los tintes funcionales se utilizan, entre otras cosas, en medicina, farmacia, energía fotovoltaica, para almacenamiento de datos y en la industria de la impresión.
Fundamentos químico-físicos
El espectro de luz es visible para los humanos en el rango de longitud de onda entre 380 y 790 nm. Cuando la luz blanca incide en un cuerpo, el espectro de luz se refleja en parte y se absorbe en parte. Si, por ejemplo, se absorben componentes de onda corta del color de la luz ( violeta a azul , 420-480 nm), la radiación emitida contiene principalmente componentes de onda larga (hasta 780 nm) y la impresión de color, la denominada color del cuerpo , es de amarillo a rojo .
Los tintes también absorben y reflejan parte de la luz blanca visible y el ojo percibe la mezcla de los colores complementarios de la luz absorbida.


Las propiedades colorantes de un compuesto químico son el resultado de su estructura química. Mientras que las moléculas con enlaces σ absorben energía electromagnética en el rango de rayos X y UV , las moléculas con electrones en enlaces π (enlaces insaturados) ya están excitadas por radiación electromagnética con menor energía. Si hay varios enlaces insaturados conjugados en la molécula, los electrones π se deslocalizan y, a medida que aumenta el grado de conjugación, la distancia energética entre el estado fundamental y el estado de energía excitada de la molécula disminuye . El máximo de absorción se desplaza hacia longitudes de onda más largas y hacia el rango visible del espectro. (→ efecto bathocrómico )
Tales estructuras moleculares se basan en la teoría de los tintes de Otto Nikolaus Witt como cromóforos , respectivamente. Los grupos funcionales de la molécula que actúan como donantes de electrones o como aceptores de electrones influyen en el mesomerismo de la molécula aumentando o disminuyendo la densidad electrónica del grupo cromofórico. También se les conoce como auxocromos o antiauxocromos.
Los grupos auxocrómicos son, por ejemplo, los grupos hidroxilo , éter , amino y amido , y los grupos antiauxocrómicos son los grupos carbonilo , nitro , carboxilo y sulfo .
Clasificación de tintes
La clasificación más común de los distintos tintes se basa en su estructura química o según su proceso técnico de aplicación del teñido.
Clasificación según estructuras químicas
Tintes de antraquinona
La estructura básica de este grupo de tintes es la antraquinona . Variando los sustituyentes, se pueden conseguir casi todos los tonos de amarillo a rojo y de azul a verde, siendo los tintes de antraquinona rojo y azul de particular importancia. El sistema de quinoides se puede convertir en la correspondiente hidroquinona soluble en agua por reducción , de modo que los colorantes de antraquinona se pueden usar como colorantes de tina . Con sustituyentes adecuados, se pueden usar tintes de antraquinona como tintes dispersos para teñir fibras sintéticas. Los tintes de antraquinona solubles en agua con grupos de ácido sulfónico se utilizan como tintes ácidos o reactivos .
Tintes azoicos
Los colorantes azo contienen un grupo azo sustituido por radicales arilo o alquenilo como estructura básica . Los tintes azo con varios grupos azo se denominan tintes bisazo (también disazo), trisazo, tetrakisazo, polyazo. Los sustituyentes arilo son habitualmente derivados de benceno o naftaleno , pero también aromáticos heterocíclicos, como pirazoles o piridonas . Como sustituyentes alquenilo se utilizan grupos alifáticos enolizables, por ejemplo anilidas sustituidas de ácido acetoacético .
La síntesis de colorante tiene lugar por diazotación de aminas aromáticas y posterior acoplamiento azo de la sal de diazonio a compuestos aromáticos ricos en electrones o β-dicarbonilo. Los colorantes azoicos son, con mucho, el grupo de colorantes más importante y extenso y están representados en casi todas las categorías de colorantes técnicos de aplicación (→ clasificación según los procesos técnicos de aplicación ). No se conocen tintes azoicos de origen natural. Con la excepción del turquesa o un verde brillante , casi todos los tonos de color se pueden lograr con tintes azoicos. El grupo azo es sensible a los agentes reductores : se escinde y, como resultado, el tinte se decolora.
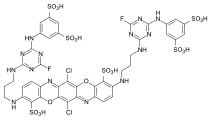
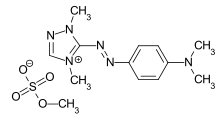
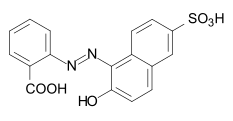
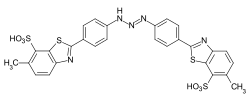
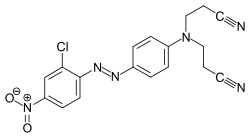
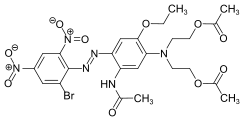
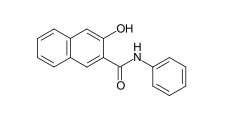
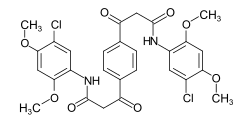
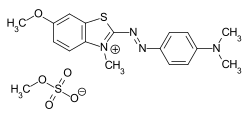
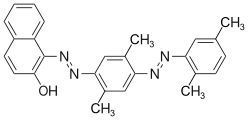
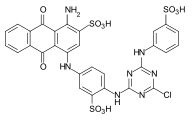
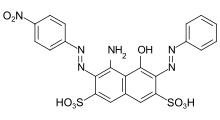
Algunos ejemplos de diferentes tipos de colorantes azoicos (colorantes mono y bisazo / benceno, residuos de naftaleno / piridona, componente de acoplamiento de acetoacetanilida / colorante de complejo metálico):
Colorantes de dioxazina
Los tintes de dioxazina, también conocidos como tintes de trifenodioxazina, contienen trifenodioxazina como estructura básica. Los tintes fuertes y brillantes tienen buenas propiedades de solidez y, por tanto, combinan las ventajas de los tintes azoicos y los tintes de antraquinona. Los colorantes de dioxazina están disponibles comercialmente como colorantes directos y reactivos.
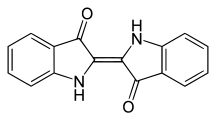
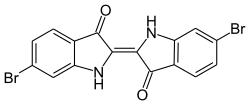
Tintes índigoides
Los tintes índigoides pertenecen a los tintes de carbonilo y se utilizan como tintes de tina. El representante más importante es el índigo, que se obtenía como tinte natural de plantas en la antigüedad y que todavía se produce industrialmente en grandes cantidades y se utiliza en particular para teñir blue jeans .
Otro tinte natural es el violeta antiguo ( CI Natural Violet 1 / Dibromoindigo ).
Tintes de complejos metálicos
Los colorantes de complejos metálicos son compuestos de coordinación de un ión metálico con uno o más ligandos de colorante que tienen grupos donantes de electrones . Predominan los compuestos de cobre y cromo , pero los complejos de cobalto , níquel y hierro también se utilizan como colorantes en menor medida . Los ligandos son a menudo colorantes azoicos , colorantes de azometina , formazanos o ftalocianinas . Los tintes de complejos metálicos se caracterizan por muy buenas propiedades de solidez.
Tintes de formazán
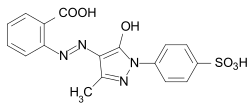
Los colorantes formazán están relacionados estructuralmente con los colorantes azoicos. La estructura básica es 1,3,5 - trifenilformazan . Forman complejos de quelatos con metales de transición como el cobre , el níquel o el cobalto . Dependiendo de los otros sustituyentes, los formazanos no acomplejados son de color naranja a rojo intenso, los formazanos complejos metálicos de color púrpura, azul a verde. La síntesis se lleva a cabo mediante el acoplamiento de sales de diazonio de hidrazonas .
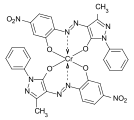
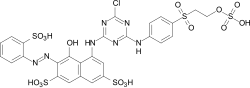
Los complejos de quelatos de cobre tetradentados azules de varios formazanos, que se utilizan en particular como colorantes reactivos para el algodón, son de importancia comercial:
Colorantes de ftalocianina
Los colorantes de ftalocianina son de cobre - o níquel - complejos de metal con la estructura básica de la ftalocianina . Están relacionados estructuralmente con las porfirinas , con las que tienen en común el elemento anuleno aza [18] . Al introducir sustituyentes solubles en agua, principalmente a través de la sulfocloración , se puede acceder a los tintes de turquesa a verde brillante. Los colorantes de ftalocianina se caracterizan por una excelente solidez a la luz.
Colorantes de metino
El metino o polimetino tienen como un sistema cromóforo conjugado enlaces dobles, con dos grupos terminales como electrón aceptor A y donador de electrones D función. Los grupos terminales, que en la mayoría de los casos contienen átomos de nitrógeno u oxígeno, pueden ser parte de un heterociclo y los dobles enlaces parte de un sistema aromático. Si uno o más grupos de metino son reemplazados por átomos de nitrógeno, se habla de colorantes de metino análogos a aza. Esto da como resultado diferentes subclases:
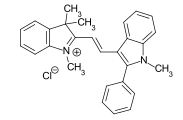
- Colorantes de cianina en los que los dobles enlaces conjugados están flanqueados por un grupo amino terciario y un grupo amonio cuaternario . Si dos grupos metino son reemplazados por átomos de nitrógeno y un grupo terminal es parte de un heterociclo, mientras que el segundo grupo terminal es de cadena abierta, se obtienen los importantes colorantes diazahemicianina. Ejemplo: CI Basic Red 22 .
- Tintes de estirilo : al insertar un anillo de fenilo en la estructura del polieno, tienen un elemento estructural de estireno . Ejemplo: CI Disperse Yellow 31 .
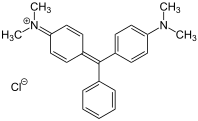
- Tintes de triarilmetina, también denominados en la literatura más antigua tintes de triarilmetano , ya que se derivan de trifenilmetano en el que al menos dos de los anillos aromáticos tienen sustituyentes donantes de electrones. Ejemplo: CI Basic Green 4 (verde malaquita).
Colorantes nitro y nitroso
En el caso de los tintes nitro , hay un grupo nitro en un anillo aromático en la posición orto de un donante de electrones, ya sea un grupo hidroxi (-OH) o un grupo amino (-NH 2 ). El representante más antiguo de esta clase de colorantes es el ácido pícrico (2,4,6-trinitrofenol). Sin embargo, los colorantes hidroxinitro ya no tienen importancia comercial. Es una clase de tintes relativamente pequeña pero antigua, cuyos representantes se caracterizan por una alta resistencia a la luz y facilidad de fabricación. Los tintes nitro son de color amarillo a marrón. Dado que son moléculas relativamente pequeñas, un área importante de aplicación como tintes dispersos es el teñido de fibras de poliéster. También se utilizan como tintes ácidos y pigmentarios.
Los colorantes nitrosos raros son compuestos aromáticos con un grupo nitroso . Los tintes nitroso con un grupo hidroxilo en posición orto con respecto al grupo nitroso se utilizan exclusivamente como complejos metálicos. Un representante típico es Naphtol Green B (CI Acid Green 1).
Colorantes de azufre
Los tintes de azufre (tintes de sulfina) son tintes macromoleculares insolubles en agua que tienen enlaces disulfuro u oligosulfuro entre radicales aromáticos. Se obtienen fundiendo derivados de benceno , naftaleno o antraceno con polisulfuros de azufre o sodio y son de constitución no uniforme . Son particularmente adecuados para teñir algodón y, al igual que los tintes de tina, se reducen a la forma soluble en agua con sosa cáustica y ditionitas o sulfuro de sodio ( compuesto leuco ) y, después de unirse a la fibra, se fijan insolubles sobre la fibra por oxidación . Por razones toxicológicas y ecológicas, ahora se evita en gran medida la oxidación con dicromato y cada vez se utilizan más colorantes de azufre con bajo contenido de sulfuro y agentes reductores libres de sulfuro. Debido a los bajos costos de producción, los colorantes azufrados continúan desempeñando un papel importante en términos de cantidad. Los tintes de azufre son particularmente lavables y resistentes a la luz, los colores suelen ser apagados.
Clasificación según la tecnología de aplicación
Si bien el matiz de color de un tinte está determinado esencialmente por el cromóforo, las propiedades de los tintes se pueden variar incorporando grupos químicos adecuados de tal manera que se puedan colorear diferentes tipos de sustrato. Esto da como resultado una clasificación de los diferentes tintes según el proceso de teñido. Esta clasificación también es seguida por el Índice de color , un trabajo estándar importante en el campo de la química de los tintes. A partir del índice de color (CI), el tintorero puede identificar qué clase de tinte, qué color y qué sustancia es. El CI contiene más de 10,000 tintes, más del 50% de ellos son tintes azo.
Tintes mordantes
El nombre se deriva del proceso de teñido en el que se aplican tintes ácidos adecuados al material teñido , principalmente lana y seda. Para teñir con tintes, las fibras a teñir se tratan primero con sales de cromo (III), hierro (III) o aluminio y se tiñen. Durante el tratamiento posterior con vapor, se forman hidróxidos metálicos sobre la fibra. Al colorear, estos hidróxidos reaccionan con el tinte ácido (en su mayoría especial) para formar un tinte de complejo metálico . El proceso de la fibra corresponde al barnizado .
Si se utilizan sales de cromo, se habla de tintes cromáticos. Dependiendo del tipo de tinte de tinción , la sal de cromo, generalmente cromatos o dicromatos, se puede agregar antes, durante o después del teñido. En consecuencia, se hace una distinción entre los procesos de cromado de baño previo, posterior y de un solo baño. Los colorantes de cromado son particularmente notables por su muy buena solidez en húmedo. Sin embargo, la contaminación de las fibras por metales pesados y las aguas residuales del teñido es desventajosa y ecológicamente crítica.
Los tintes de tinción se designan como tintes CI Mordant según el índice de color .
Ejemplos:
Tintes directos
Debido a su alta sustantividad, los colorantes directos (o colorantes sustantivos) se absorben directamente de la solución acuosa sobre la fibra. Son particularmente adecuados para su uso en celulosa . Estos tintes se unen a la fibra a través de interacciones físicas ( enlaces de van der Waals ). La mayoría de los representantes provienen del grupo de tintes azo, preferiblemente tintes poliazo.
Los tintes directos se denominan tintes CI Direct según el índice de color .
Ejemplos:
Tintes dispersos
Los colorantes dispersos casi insolubles en agua se utilizan preferiblemente para teñir fibras de poliéster y acetato hidrófobas . Se muelen muy finamente junto con dispersantes , lo que significa que los componentes del tinte disueltos molecularmente pueden difundirse en la fibra durante el proceso de teñido, donde forman una solución sólida, dando como resultado tinturas que son lavables y resistentes a la luz.
La gran mayoría de los colorantes dispersos pertenecen a los colorantes azoicos. Debido a las fibras de poliéster mecánicamente de alta calidad, los tintes dispersos son un grupo muy importante de tintes. El importe total negociado en 1999 para Europa Occidental tuvo un valor de venta de 98 millones de euros.
Los tintes dispersos se denominan tintes dispersos CI según el índice de color .
Ejemplos:
Colorantes de revelado o copulación
En el caso de los tintes reveladores, se forma un colorante prácticamente insoluble en agua directamente sobre la fibra mediante la reacción de un componente de acoplamiento soluble en agua ( Componente de acoplamiento CI Azoico ) con un componente diazo soluble en agua (Componente CI Azoico Diazo ). Esta clase de tintes se utiliza principalmente para teñir fibras de celulosa, caracterizándose los tintes por una muy buena solidez en húmedo. El componente de acoplamiento más importante en los colorantes de desarrollo es el Componente de acoplamiento 2 CI (Naftol AS) .
Colorantes catiónicos
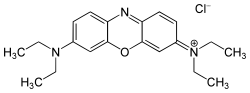
Los colorantes catiónicos son compuestos con carga positiva que, cuando se combinan con fibras de poliacrilonitrilo (PAN) y poliéster modificado aniónicamente , producen colores brillantes y resistentes a la luz. Forman enlaces iónicos con grupos cargados negativamente en la fibra. Se pueden usar diferentes cromóforos para colorantes catiónicos, estando deslocalizada la carga positiva en los colorantes de metino en contraste con otros sistemas cromofóricos.
Incluso si los tintes catiónicos llevan el nombre del índice de color con tintes básicos CI , el término tintes básicos para este grupo de tintes ya no se utiliza en la literatura más reciente.
Tintes de tina
Los tintes de tina incluyen pigmentos insolubles en agua, que se llevan a su forma soluble dihidro o leuco por reducción ( encubado ) en una solución alcalina para colorear . El anión muestra suficiente afinidad por las fibras de algodón o viscosa para que pueda absorberse el tinte de la tina. Aquí se convierte de nuevo al estado insoluble por oxidación posterior . Esto se puede hacer mediante oxígeno atmosférico o tratamiento con agentes oxidantes. El tinte se fija casi molecularmente a la fibra, esta "precipitación en la fibra" provoca el alto lavado y la resistencia a la luz. Los tintes de azufre insolubles en agua también se comportan como los tintes de tina.
El tinte de tina más importante es el índigo . Los tintes de indantreno también son importantes.
Los tintes de tina se designan como tintes de tina CI de acuerdo con el índice de color .
Ejemplos:
Colorante alimenticio
Los colorantes alimentarios se utilizan como aditivos alimentarios para compensar los cambios de color relacionados con el procesamiento o para satisfacer las expectativas de color de los consumidores. Se utilizan tanto tintes de origen natural como tintes producidos sintéticamente. El uso de tintes como colorantes alimentarios está estrictamente regulado por la ley: en la UE por el Reglamento (CE) n. ° 1333/2008 del 16 de diciembre de 2008 sobre aditivos alimentarios. Solo se pueden comercializar aditivos alimentarios aprobados con número E. Estos aditivos deben estar identificados en el producto.
Los colorantes alimentarios se denominan colorantes alimentarios CI según el índice de color .
Tintes solventes
Los tintes solventes, denominados según el índice de color de los tintes solventes , son tintes insolubles en agua que son solubles en varios solventes orgánicos como alcoholes, ésteres o hidrocarburos. Por regla general, las estructuras de los colorantes solventes no contienen ningún ácido sulfónico o grupos carboxi. Se excluyen los colorantes catiónicos con un grupo sulfonato o carboxilato intramolecular como contraanión. Se pueden encontrar representantes de los tintes solventes en varias clases de tintes químicos, desde los tintes azoicos, tintes de antraquinona, tintes de complejos metálicos hasta ftalocianinas. Los tintes solventes se utilizan como componente de lacas (ejemplo: tintes para barnices de zapon ), para colorear productos de aceite mineral ( tintes de Sudán ), ceras , tintas y diversos plásticos transparentes.
Los tintes solventes se denominan tintes solventes CI según el índice de color .
Ejemplos:
Tintes reactivos
Durante el proceso de teñido, los tintes reactivos forman un enlace covalente con los grupos funcionales de la fibra , lo que da como resultado un teñido resistente a la humedad. Son el grupo más grande de tintes para teñir celulosa, pero también se pueden usar para teñir lana y poliamida en tonos profundos.
Desde un punto de vista químico, los colorantes reactivos constan de dos partes: un cromóforo y uno o más grupos reactivos, también conocidos como anclajes reactivos. Son importantes dos sistemas de anclaje reactivo diferentes:
- Compuestos heterocíclicos, por ejemplo triazina sustituida con halógeno o derivados de pirimidina . Durante el proceso de teñido, estos reaccionan con los grupos hidroxilo de las fibras, separando el haluro de hidrógeno y formando un enlace éter covalente estable :
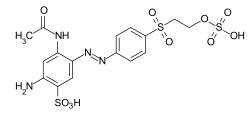
- El llamado grupo vinilsulfona , que reacciona con los grupos nucleofílicos de la fibra durante el proceso de teñido en el sentido de una adición de Michael . También en este caso se forma un enlace éter estable. En el caso de muchos tintes de vinil sulfona , el grupo vinil sulfona está en una forma protegida como un semiester de ácido sulfúrico. El grupo vinilsulfona solo se forma mediante la eliminación del ácido sulfúrico en las condiciones alcalinas de tintura .
Los dos tipos de anclajes reactivos también pueden estar presentes en paralelo en un tinte reactivo.
Como cromóforo, los colorantes azoicos son, con mucho, los más comunes entre los colorantes reactivos. Sin embargo, también juegan un papel importante otros sistemas cromofóricos como los colorantes de antraquinona, formazán y ftalocianina.
Los tintes reactivos se denominan tintes reactivos CI según el índice de color .
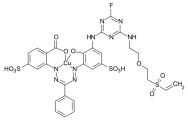
Ejemplos:
Tintes ácidos
Los colorantes ácidos tienen sustituyentes aniónicos hidrófilos ; por regla general, estos son grupos de ácido sulfónico. La mayoría de los representantes de esta clase de tintes pertenecen a los tintes azo, pero también hay tintes ácidos con otros cromóforos. Se utilizan principalmente para teñir lana, seda y poliamida, el proceso de teñido tiene lugar en el rango de pH 2-6. Si se utilizan pequeñas moléculas de colorante, se obtienen tinciones uniformes en las que las moléculas de colorante forman principalmente enlaces salinos con los grupos amonio de la fibra. El comportamiento de lavado ( solidez en húmedo ) es bastante moderado con estos productos. A medida que aumenta el tamaño de la molécula, aumenta la unión del tinte a través de las fuerzas de adsorción entre la parte hidrófoba de la molécula de tinte y la fibra. Esto mejora la solidez en húmedo, pero en muchos casos a expensas de la uniformidad (nivelación) del teñido.
Los tintes ácidos se denominan tintes ácidos CI según el índice de color .
Ejemplos:
CI Acid Blue 3 ( azul patente V )
Tintes funcionales
Mientras que los tintes convencionales se utilizan, por ejemplo, para cambiar la apariencia de textiles, cuero y papel, los tintes funcionales generalmente no tienen ningún propósito estético. Las áreas de aplicación típicas son los tintes indicadores o los tintes dependientes del voltaje.
Tintes especiales pueden
- Absorber luz a una determinada longitud de onda y convertir la luz absorbida en calor (por ejemplo, en análisis químicos y bioquímicos),
- emitir la luz nuevamente en una longitud de onda diferente (como biomarcadores o tintas fosforescentes, fluorescencia en láseres de tinte, quimioluminiscencia para romper o restablecer enlaces químicos en bioquímica),
- cambiar la dirección de polarización de la luz (como con la duplicación de frecuencia o como un interruptor óptico),
- Causar fenómenos eléctricos (utilizado en impresoras láser),
- Permitir los procesos fotoquímicos.
Desde un punto de vista económico, el uso de tintes funcionales para la producción de CD y DVD es particularmente importante. Las moléculas de colorante están contenidas en el policarbonato de un CD o DVD. Las moléculas de colorante absorben la energía luminosa a través del rayo láser del quemador y la convierten en calor. Como resultado de la absorción de calor, el plástico, el policarbonato, se derrite en este punto. La superficie ha cambiado ligeramente, la estructura de la superficie modificada se percibe durante el proceso de lectura.
Producción de tintes industriales
Además de las reacciones químicas, la producción de tintes industriales incluye varios procesos físicos, como la salazón , la filtración , la ósmosis inversa (RO) , el secado y la trituración.
Antes o después del secado, los tintes comerciales se estandarizan a una cierta intensidad de color mediante la adición de agentes de ajuste indiferentes e incoloros, como sulfato de sodio, cloruro de sodio o dextrina, para compensar las fluctuaciones en los diferentes lotes de producción. La adición dirigida de otros tintes (tintes de sombreado) puede garantizar que el producto comercial se mantenga constante en color. En algunos casos, la estabilidad de almacenamiento de los productos puede aumentarse mediante la adición de sustancias tampón como el fosfato mono y disódico .
En particular, con tintes poco solubles en agua, el pulido tiene una gran influencia en el proceso de teñido (tono de color , intensidad del color ). En las décadas de 1960 y 1970, además de los colorantes en polvo, se comercializaron soluciones de colorantes acuosas cada vez más concentradas. Con la introducción de marcas líquidas, como el desarrollo de granulados de tinte, se ha facilitado la dosificación automática de tinte en los talleres de tintura y se ha reducido la contaminación por polvo.
Antes de 1980, la producción de tintes industriales era muy fuerte en Europa Occidental, América del Norte y Japón. El aumento de los costos de protección ambiental y la creciente presión de importación de Asia por parte de muchos fabricantes de tintes no tradicionales, en particular de China, India, Corea y Tailandia, llevaron a una reestructuración significativa entre los fabricantes de tintes tradicionales. El negocio de tintes se concentró a través de adquisiciones y empresas conjuntas, como resultado de lo cual se cerraron muchas instalaciones de producción.
Los grandes fabricantes de tintes tradicionales son Huntsman (antes Ciba ), DyStar (surgido de las divisiones de tintes de Hoechst AG , Bayer AG y BASF ) y Archroma (surgido de Clariant ). Estos fabricantes de tintes tradicionales ahora producen principalmente en Asia.
Ver también
- Lista de tintes , ordenados por color
- Teñir en la antigüedad.
literatura
- Heinrich Zollinger: Química del color: Síntesis, propiedades y aplicaciones de tintes y pigmentos orgánicos . 3. Edición. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3 ( vista previa limitada en la búsqueda de libros de Google).
- Klaus Hunger (Ed.): Tintes industriales: química, propiedades, aplicaciones . WILEY-VCH Verlag, Weinheim 2003, ISBN 3-662-01950-7 ( vista previa limitada en la búsqueda de libros de Google).
- Jürgen Fabian, Horst Hartmann: Absorción de luz de colorantes orgánicos. Tratamiento teórico y reglas empíricas . Springer, Berlín 1980, ISBN 3-642-67589-1 ( vista previa limitada en la búsqueda de libros de Google).
- Martin Klessinger: Constitución y ligera absorción de colorantes orgánicos . En: Química en nuestro tiempo . cinta 12 , 1978, pág. 1-11 .
- Guido Ebner, Dieter Schelz: Teñido y tintes de textiles . Springer-Verlag, Berlín 1989, ISBN 3-642-70172-8 ( vista previa limitada en la búsqueda de libros de Google - reimpresión 2011).
- Wilfried Kratzert, Rasmus Peichert: Tintes . Quelle y Meyer, Heidelberg 1981, ISBN 3-494-01021-8 .
- Helmut Schweppe: Manual de tintes naturales. Ocurrencia - uso - evidencia . ecomed, Landsberg / Lech 1993, ISBN 3-609-65130-X .
- Lutz Roth, Kurt Kormann, Helmut Schweppe: Plantas de tinte - colores de plantas. Botánica - métodos de teñido - análisis - alfombras turcas y sus motivos . ecomed, Landsberg / Lech 1992, ISBN 3-609-65490-2 .
- Sabine Struckmeier: Tintes naturales: colores con historia . En: Química en nuestro tiempo . cinta 37 , no. 6 , 2003, pág. 402-409 , doi : 10.1002 / ciuz.200300275 .
- Herbert Vogler: El teñido se ha realizado durante miles de años: una descripción general del teñido antiguo . En: acabado textil . cinta 21 , no. 6 , 1986, págs. 229-235 .
- Herbert Vogler: 150 años de la industria de los tintes. Primera parte . En: acabado textil . cinta 42 , no. 11/12 , 2007, págs. 11-14 ( tib.eu ).
- Herbert Vogler: 150 años de la industria de los tintes. Parte II . En: acabado textil . cinta 43 , no. 1/2 , 2008, pág. 10-14 ( tib.eu ).
- Anthony Travis: The Rainbow Makers: El origen de la industria de colorantes sintéticos en Europa occidental . Lehigh Univ. Prensa, Belén / Londres / Toronto 1993, ISBN 0-934223-18-1 .
enlaces web
- Thomas Seilnacht: Lexicon of pigments and colorantes en seilnacht.com, consultado el 7 de enero de 2017.
- Lexicon of Dye Plants en digitalefolien.de, consultado el 7 de enero de 2017.
- J. Scherkenbeck: Dyes ( Memento del 8 de enero de 2017 en Internet Archive ) (PDF; 2,16 MB)
Evidencia individual
- ↑ DIN 55943 . En: Instituto Alemán de Normalización e. V. (Ed.): Colorantes 1 . 7ª edición. DIN-Taschenbuch 49 Berlín, Viena, Zúrich 2012, ISBN 978-3-410-23202-5 , págs. 509 .
- ↑ a b c Wolfgang Glöckner, Walter Jansen, Rudolf G. Weißenhorn (eds.): Manual de química experimental, nivel secundario II. Volumen 10, Aulis Verlag Deubner & Co. KG, Colonia 2008, ISBN 978-3-7614-2388 -2 , págs. 304-309.
- ^ A b c Christian-Herbert Fischer: tintes históricos . En: Espectro de la ciencia . No. 10, 1997, pág.104 y sigs.
- ↑ Enciclopedia de química técnica de Ullmann . 4ª edición. Volumen 11, palabra clave: tintes, naturales. Pág. 103.
- ^ Karl Aloys Schenzinger: Anilina. Zeitgeschichte-Verlag Berlín, 1937, OCLC 6866470 .
- ↑ George B. Kauffman: Pittacal - El primer colorante sintético. En: Revista de Educación Química. 54, 1977, pág. 753, doi: 10.1021 / ed054p753 .
- ^ Karl Huebner: Historia: 150 años de Mauvein . En: Química en nuestro tiempo . cinta 40 , no. 4 , 2006, pág. 274-275 , doi : 10.1002 / ciuz.200690054 .
- ↑ Hans Joachim Störig : Pequeña historia mundial de la ciencia 2. 4. Edición. Fischer Taschenbuch, 1982, ISBN 3-596-26399-9 , págs. 136-137.
- ↑ a b Hermann Raaf: Química orgánica en un vaso de prueba. 13a edición, Kosmos Verlag, Stuttgart 1975, ISBN 3-440-04266-9 , p. 186.
- ↑ Joachim Rudolf: libro de química moderna de Knauer. Th. Knauer Nachf., Múnich / Zúrich 1975, ISBN 3-426-00381-3 , págs. 257-263.
- ↑ a b c 1865-1901: La edad de los colores . basf.com. Consultado el 9 de noviembre de 2018.
- ↑ Renate Kaiser-Alexnat: Indigo - El rey de los tintes . En: Revista del Sudeste Asiático . Número 3, 2008 ( vista previa limitada en la Búsqueda de libros de Google).
- ↑ Ernst Bäumler: La fábrica roja . R. Piper GmbH & Co. KG, Munich 1988, ISBN 3-492-10669-2 .
- ↑ Historia de la empresa Bayer AG , consultado el 8 de noviembre de 2018
- ↑ Werner Abelshauser (ed.): La BASF: una historia de la empresa . 2ª Edición. CH Beck, Munich 2003, ISBN 3-406-49526-5 ( vista previa limitada en la búsqueda de libros de Google).
- ^ A b Klaus Hunger (Ed.): Tintes industriales: química, propiedades, aplicaciones . WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ John Griffiths: Tintes funcionales. Una nueva tendencia en la química de los tintes . En: Química en nuestro tiempo . cinta 27 , no. 1 . Wiley-VCH Verlag, Weinheim 1993, pág. 21-31 , doi : 10.1002 / ciuz.19930270104 .
- ↑ Tintes funcionales: desde las raíces de la química de los tintes hasta los productos de alto contenido químico . chemanager-online.com. Consultado el 13 de noviembre de 2018.
- ↑ K. Peter C. Vollhardt: Química orgánica. VCH, Weinheim, 1ª edición 1988, p. 618, ISBN 3-527-26912-6 .
- ↑ Entrada sobre tintes de cianina. En: Römpp Online . Georg Thieme Verlag, consultado el 4 de febrero de 2019.
- ↑ Entrada sobre tintes de triarilmetano. En: Römpp Online . Georg Thieme Verlag, consultado el 14 de enero de 2019.
- ^ A b Heinrich Zollinger: Química del color: síntesis, propiedades y aplicaciones de tintes y pigmentos orgánicos . 3. Edición. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ Entrada sobre colorantes azufrados. En: Römpp Online . Georg Thieme Verlag, consultado el 14 de enero de 2019.
- ↑ Kirk-Othmer, Jacqueline I. Kroschwitz: Enciclopedia de tecnología química. 5a edición, Vol. 9, 2005, ISBN 978-0-471-48494-3 , p. 349.
- ↑ P. Rys, G. Zollinger: Guía de química de tintes. 2da edición, Verlag Chemie, Weinheim 1976, ISBN 3-527-25650-4 , págs. 181, 182.
- ↑ Entrada sobre tintes cromáticos. En: Römpp Online . Georg Thieme Verlag, consultado el 23 de enero de 2019.
- ^ Bertram Philipp, Peter Stevens Características básicas de la química industrial. VCH Verlagsgesellschaft mbH, 1987, ISBN 3-527-25991-0 , p. 321.
- ^ Wittko Francke, Wolfgang Walter: Libro de texto de química orgánica. S. Hirzel Verlag, Stuttgart 2004, ISBN 3-7776-1221-9 , pág.684 y sig.
- ↑ Reglamento (CE) No. 1333/2008 del 16 de diciembre de 2008 sobre aditivos alimentarios (PDF) , consultado el 5 de agosto de 2019.
- ↑ Autorización y uso de aditivos alimentarios. Ministerio Federal de Alimentación y Agricultura, consultado el 5 de agosto de 2019 .
- ↑ H. Zollinger: Química de colorantes reactivos . En: Angew. Chem. 73, No. 4, 1961, págs. 125-136, doi: 10.1002 / anie.19610730402 .
- ↑ a b c John Griffiths: Tintes funcionales. Una nueva tendencia en la química de los tintes . En: Química en nuestro tiempo. 27, núm. 1, 1993, págs. 21-31, doi: 10.1002 / ciuz.19930270104 .
- ↑ Klaus Roth: La química de los deslumbrantes discos: CD, DVD & Co. En: Química en nuestro tiempo. 41, núm. 4, 2007, págs. 334-345, doi: 10.1002 / ciuz.200700428 .
- ^ Hermann Rath: libro de texto de química textil . incluida la tecnología química textil. 2ª Edición. Springer-Verlag, Berlín, Heidelberg 1963, ISBN 978-3-662-00065-6 , págs. 455 ( vista previa limitada en la búsqueda de libros de Google).
- ^ A b Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Karl Winnacker, Leopold Küchler: Tecnología, procesos y productos químicos. Volumen 7, Productos industriales, 5ª edición. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-30772-9 , pág.397 y siguientes.