Doble enlace
Un doble enlace es una forma de enlace covalente que involucra cuatro electrones de enlace . Por tanto, los dos átomos están conectados entre sí mediante dos pares de electrones enlazados . En fórmulas estructurales , los dobles enlaces se representan como dos líneas paralelas (=) entre los átomos conectados.
Muchos átomos pueden formar enlaces dobles entre sí. Los grupos funcionales o clases de sustancias más comunes con dobles enlaces son los alquenos (C = C), carbonilos (C = O), sulfóxidos (S = O), iminas (C = N) y el grupo azo (N = N). .
Los enlaces dobles son más fuertes y más cortos que los enlaces simples. El orden de los bonos es dos. Los dobles enlaces son ricos en electrones, lo que los hace reactivos.
historia
Joseph Loschmidt introdujo la representación del doble enlace mediante dos líneas dobles . Alrededor de 1865 August Wilhelm von Hofmann introdujo las terminaciones -an, -en, -in para denotar alcanos saturados e insaturados.
Descripción detallada

Las relaciones de enlace de una molécula del segundo período con un doble enlace se pueden describir con sp 2 - orbitales híbridos . Los átomos vecinos de dicho átomo con hibridación sp 2 están en un plano (la molécula es plana). Los ángulos entre los átomos ligados suelen estar cerca de 120 ° (ver modelo VSEPR ), la distancia entre los átomos ligados es de alrededor de 1,34 Å. El electrón restante está en un orbital con carácter p puro perpendicular al plano molecular. Cada uno de los dos átomos que están conectados por el doble enlace tiene cada uno un orbital p ocupado individualmente . La combinación de estos dos crea un orbital π de enlace y un orbital π * antienlazante.
Este tipo de doble enlace no está restringido al segundo período, pero se encuentran diferentes patrones de enlace en los dobles enlaces entre elementos de los períodos superiores. Las razones de esto son, por un lado, energías de unión homonucleares generalmente más bajas para átomos más grandes y, por otro lado, una menor tendencia a la hibridación de los orbitales de valencia syp. En ciertos casos, la coincidencia de estos fenómenos significa que la energía que se requiere para llevar los fragmentos moleculares subyacentes al sistema de doble enlace a un estado enlazable ya no puede ser aplicada por la energía de enlace liberada posteriormente. En tales casos, estos fragmentos (es decir, moléculas análogas o homólogas al carbeno ) se obtienen como compuestos aislables, o la dimerización se produce mediante una doble reacción ácido-base de Lewis y da como resultado dos enlaces donante-aceptor (un enlace doble dativo). Tal doble enlace, que se observa, por ejemplo, en el caso de los homólogos de carbono superior, puede reconocerse por una estructura característica (flexión transdoblada de los sustituyentes) y la baja energía requerida para separar el enlace. La energía de disociación puede incluso ser significativamente menor que la de un enlace sencillo covalente normal. Los ejemplos típicos de tales sistemas de doble enlace son los distannenos (R 2 Sn = SnR 2 ) y Diplumbene (R 2 Pb = PbR 2 ).
La brecha de energía entre el orbital π de enlace y el orbital π * antienlazante suele ser más pequeña que la brecha de energía entre un orbital σ correspondiente y un orbital σ * antienlazante. En el caso de los dobles enlaces conjugados , la energía de excitación cae tanto que la luz visible puede ser suficiente para llevar un electrón a un orbital vacío. Cuanto mayor sea el número de dobles enlaces conjugados, menos energía (luz de onda más larga) se requiere (ver también: Partículas en el recuadro ). En el caso del caroteno con once dobles enlaces conjugados, la luz azul se absorbe y la molécula aparece naranja (el color complementario naranja surge de la sustracción del componente azul de la luz blanca irradiada ).
Longitudes de enlace y ángulos de enlace
Las longitudes de los enlaces dobles entre dos átomos en sistemas no conjugados son más cortas que las de los enlaces simples correspondientes entre los mismos átomos.
Longitudes de enlace y ángulos de enlace de dobles enlaces seleccionados 
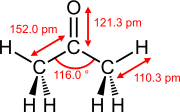

Eteno (etileno) acetona Dimetilsulfóxido
nomenclatura
La rotación alrededor de un doble enlace no es posible fácilmente. Si ambas parejas de unión tienen dos diferentes sustituyentes , se hace una distinción entre cis y trans isómeros con respecto a su posición entre sí .
Varios dobles enlaces que están separados exactamente por un enlace sencillo se denominan conjugados , los directamente adyacentes entre sí como acumulados y, si hay más de un enlace sencillo, como aislados hasta el siguiente doble enlace .
Reacciones químicas típicas de moléculas con doble enlace.
- C = C doble enlace ( alquenos ):
-
adición electrofílica al doble enlace
- Otra molécula (electrofílica) se une a la molécula después del ataque de E + (E + = electrófilo) y un intermedio iónico, rompiendo el doble enlace o, en el caso de electrófilos con átomos más grandes (por ejemplo, bromo ), formando un anillo. -formado, iónico uno Etapa intermedia (“- ion de onio ”, aquí también ion de bromonio) con ataque posterior en la parte posterior del resto (en el ejemplo Br - ).
-
adición de radicales al doble enlace
- una molécula cuyo enlace se puede dividir homolíticamente fácilmente (en dos radicales) (por ejemplo, cloro ) se divide en dos radicales bajo luz (UV), que luego atacan el doble enlace.
-
adición electrofílica al doble enlace
- C = O doble enlace ( carbonilo , cetona , aldehído , ácido carboxílico , éster de ácido carboxílico ):
- Reducción del enlace C = O a alcoholes con reactivos reductores como hidrógeno o reacciones de Grignard .
- Oxidación del enlace C = O (solo aldehído) a un ácido carboxílico.
- Reacción de Passerini .
- C = N doble enlace
- Adición de ácido cianhídrico con formación de α-aminonitrilos.
- Reacción de Ugi
- reacciones pericíclicas
Para más reacciones, ver también reacciones de nombre , doble enlace acumulativo .
Detección de dobles enlaces C = C
Es posible una detección bastante inespecífica de compuestos orgánicos con dobles enlaces C = C, es decir, de alquenos , utilizando agua de bromo . Si está presente un alqueno, el agua de bromo , que ha sido coloreada de amarillo por Br 2, se decolora con la muestra después de agitar. Se forma un bromoalcano a partir del alqueno mediante una reacción de adición . Para obtener más información, consulte la detección de alquenos .
Ver también
- Regla del doble enlace
- Equivalente de doble enlace
- Isomería cis - trans [ isomería ( EZ )]
- interacción π-π
Evidencia individual
- ^ Siegfried Hauptmann : Química orgánica , segunda edición revisada, VEB Deutscher Verlag für Grundstoffindindustrie, Leipzig, 1985, p. 54, ISBN 3-342-00280-8 .




