Metalocenos
Los metalocenos son un grupo de compuestos organometálicos en los que se dispone un átomo de metal central como en un sándwich entre dos ciclopentadienil - ligando (C 5 H 5 , abreviatura: Cp). Por consiguiente, los metalocenos se denominan compuestos sándwich . El descubrimiento del primer metaloceno, el ferroceno , que fue sintetizado por casualidad de forma independiente por dos equipos de investigación diferentes en 1951 , se considera ahora uno de los hitos de la química organometálica y el punto de partida para un rápido desarrollo de una nueva rama de la química. Más del 80% de los complejos organometálicos actuales son complejos de ciclopentadienilo.
Los metalocenos se utilizan de muchas formas. Se utilizan para la producción de diodos emisores de luz . Derivados de los metalocenos, tales como dicloruro de titanoceno son adecuados como catalizadores para la olefina - polimerización con una alta productividad y selectividad . En la terapia de tumores, algunos derivados de metaloceno muestran propiedades citostáticas . El ferroceno se puede utilizar, entre otras cosas, para aumentar la resistencia a la detonación de los combustibles (como sustituto del tetraetilo de plomo ) y mejorar su combustión.
En 1973, Ernst Otto Fischer y Geoffrey Wilkinson recibieron el Premio Nobel de Química por su trabajo sobre compuestos organometálicos y la elucidación de las relaciones de enlace en el ferroceno .
historia
En 1951, Tom J. Kealy y Peter L. Pauson de la Universidad de Duquesne intentaron la preparación de fulvaleno haciendo reaccionar cloruro férrico con bromuro de ciclopentadienil magnesio de acuerdo con la siguiente ecuación. En lugar del fulvaleno esperado, Kealy y Pauson recibieron cristales de color naranja como producto principal, que sorprendentemente eran estables en el aire y a temperaturas superiores a 300 ° C y podían sublimarse fácilmente.
El primer análisis elemental para carbono e hidrógeno mostró que el compuesto no podía ser fulvaleno, y después de algunos cálculos se sugirió la fórmula empírica C 10 H 10 Fe. La cualitativo y el análisis cuantitativo de hierro resultó difícil, sin embargo, debido a que el compuesto era resistente incluso a concentrada de ácido sulfúrico . La evidencia cualitativa de hierro solo fue posible hirviéndola con ácido nítrico concentrado . Para el análisis cuantitativo, la sustancia incluso tuvo que ser fumada con ácido perclórico (HClO 4 ) hasta que se secó.
Completamente independiente - y antes del trabajo de Tom J. Kealy y Peter L. Pauson - en el mismo año Samuel A. Miller, John A. Tebboth y John F. Tremaine en la British Oxygen Company tenían la misma sustancia a través de la reacción de ciclopentadieno : vapor producido y descrito con hierro recién reducido a 300 ° C.
Miller y sus colegas incluso enviaron su trabajo para su publicación antes que Kealy y Pauson, pero dado que Nature , la revista en la que publicaron Kealy y Pauson, publicó más rápido, su artículo se publicó antes que el de Miller. Según Miller, ya había sintetizado la sustancia tres años antes. Es posible que el ferroceno incluso se haya producido por primera vez unos años antes en Union Carbide , que estaba llevando a cabo experimentos para romper catalíticamente el ciclopentadieno en tuberías de hierro. Sin embargo, nunca se consideró ni se analizó allí.
Aunque la estabilidad de la sustancia sugirió un tipo de enlace diferente al de los pocos compuestos organometálicos conocidos anteriormente, como la sal de Zeise K [PtCl 3 (C 2 H 2 )], Kealy y Pauson inicialmente optaron por un enlace covalente del ciclopentadienilo. anillo con el hierro y sugirió la estructura opuesta. El grupo de Miller, por otro lado, asumió una estructura más iónica . Con base en los datos infrarrojos (solo una oscilación CH, correspondiente a solo un tipo de enlace CH en el anillo Cp) y el diamagnetismo encontrado , Geoffrey Wilkinson y Robert B. Woodward de la Universidad de Harvard en 1952 concluyeron que había una especie de estructura tipo sándwich. . En el mismo año Ernst Otto Fischer y Wolfgang Pfab en Munich, así como Philip Frank Eiland y Ray Pepinsky en la Pennsylvania State College confirmó esta estructura por medio de rayos X de cristal de análisis de la estructura . Como Woodward postuló que los anillos de ciclopentadienilo en el Fe (C 5 H 5 ) 2 una sustitución electrofílica debería ser accesible, Whitning y Rosenblum llevaron a cabo la primera acilación de Friedel-Crafts en el anillo de ciclopentadienilo por medio del ferroceno. A través de esto para las sustancias aromáticas, el comportamiento típico vino en analogía con el sufijo inglés -eno para sustancias aromáticas (por ejemplo, B. benceno para benceno ), el nombre propuesto ferroceno .
Casi en una especie de competencia, los dos grupos de trabajo en torno a Ernst Otto Fischer en Munich y Geoffrey Wilkinson en Harvard sintetizaron una gran cantidad de complejos de bisciclopentadienilo de otros metales de transición y sus derivados en rápida sucesión en los años siguientes :
- 1952: dibromuro de titanoceno, dibromuro de circonoceno, dicloruro de vanadoceno, rutenoceno y el catión rutenocenio
- 1953: níquelloceno, cobaltoceno, catión de nickelocenio, cromoceno, catión de rodocenio y catión de iridocenio
- 1954: vanadoceno, hidroxibromuro de titanoceno, magnesoceno, manganoceno, niobocentribromuro, tantalocentribromuro e hidruro de renoceno
En 1954 y 1955 se sintetizaron y describieron los complejos triciclopentadienilo de escandio , itrio , lantano y los lantanoides cerio , praseodimio , neodimio , samario , disprosio , erbio e iterbio . Se ha propuesto una estructura iónica para estos debido a una reacción rápida y completa con el cloruro férrico para formar ferroceno.
A partir de 1954, los dos grupos de trabajo sintetizaron los denominados semicomplejos sándwich , que contienen solo un ligando ciclopentadienilo, como (C 5 H 5 ) V (CO) 4 , (C 5 H 5 ) Mn (CO) 3 , (C 5 H 5 ) Co (CO) 2 , (C 5 H 5 ) Ni (CO), (C 5 H 5 ) Mo (CO) 3 H, [(C 5 H 5 ) Fe (CO) 2 ] 2 y ( C 5 H 5 ) Fe (CO) 2 Cl. También a través de los complejos de medio sándwich puenteados por ligandos de carbonilo (CO) (C 5 H 5 ) Mo (CO) 6 Mo (C 5 H 5 ) y (C 5 H 5 ) W (CO) 6 W (C 5 H 5 ) Fue reportado. Estrictamente hablando, sin embargo, estos compuestos de medio sándwich no pertenecen a los metalocenos en el sentido de la definición. Además de los metalocenos con ligandos de ciclopentadienilo (no sustituidos), hasta la fecha se han producido un gran número de complejos con anillos sustituidos . El ligando de pentametilciclopentadienilo (abreviatura: Cp * ) es de particular interés porque puede estabilizar estéricamente metalocenos inestables y así hacerlos aislables debido a sus grandes requisitos de espacio .
Fabricación
Dado que el ciclopentadieno se dimeriza a diciclopentadieno en una reacción de Diels-Alder a temperatura ambiente , este primero debe convertirse de nuevo en ciclopentadieno mediante escisión térmica (reacción retro-Diels-Alder). En la práctica, el ciclopentadieno se separa por destilación de su dímero en presencia de un catalizador , por ejemplo, polvo de hierro .
Los metalocenos, y generalmente los compuestos de ciclopentadienil-metal, se pueden preparar de varias formas.
Por metátesis : los primeros metalocenos se produjeron con un reactivo de Grignard , en su lugar se prefirió el ciclopentadienil sódico posterior :
También se pueden utilizar metales en el estado de oxidación + III, que inicialmente se reducen en el primer sub-paso, por lo que se puede formar 9,10-dihidrofulvaleno como subproducto:
Pero también se describe el uso de agentes reductores metálicos como el zinc :
Debido a la baja estabilidad del magnesoceno, es muy adecuado para la ciclopentadienilación, para la transferencia de unidades Cp a otros metales. La fuerza impulsora es la formación del dihaluro de magnesio estable .
En general, los compuestos de ciclopentadienil álcali se pueden preparar haciendo reaccionar bromo de 2,4-ciclopentadieno con organilos de metales alcalinos:
A partir de esto, en el siguiente paso, el complejo sándwich litoceno, que solo existe en complejos como un ion de litio aniónico, p. Ej. B. puede sintetizarse por reacción de LiCp con cloruro de tetrafenilfosfonio (PPh 4 Cl):
Por desproporción : el magnesoceno se puede obtener directamente de CpMgBr. Con este fin, el bromuro de ciclopentadienil magnesio se produce primero haciendo reaccionar bromuro de etil magnesio con ciclopentadieno, que luego se desproporciona en MgCp 2 y MgBr 2 a 220 ° C y 10 -4 mbar ( equilibrio de Schlenk ):
A partir de los componentes en presencia de bases : En 1954 Wilkinson intentó sintetizar complejos metálicos de bisciclopentadienilo con la ayuda de aminas como aceptores de haluro de hidrógeno. Sin embargo, los rendimientos del 3 al 4% fueron muy bajos. Solo con ferroceno o utilizando bases más fuertes como el hidróxido de potasio se puede mejorar significativamente el rendimiento:
Directamente a partir de los componentes: En el caso de metales reactivos , como los metales alcalinos y los metales alcalinotérreos , los compuestos de ciclopentadienilo metálico se pueden producir directamente haciendo reaccionar el metal con ciclopentadieno:
En el caso de los elementos de los grupos 4 a 12, esto solo es posible con el ferroceno especialmente estable.
El ferroceno y el cobaltoceno también se pueden generar directamente en una reacción electroquímica cuando se utilizan ánodos de hierro o cobalto y bromuro de tetrabutilamonio (Bu 4 NBr) como sal conductora:
A partir de hidruros metálicos u organilos metálicos: Los complejos bisciclopentadienilo de calcio , estroncio y bario se pueden obtener haciendo reaccionar los hidruros correspondientes con ciclopentadieno:
La conversión de compuestos de diorganil metal , como dibutil magnesio , con ciclopentadieno es posible a escala de laboratorio .
Los metalocenos de los grupos 4 y 5 se pueden preparar reduciendo los correspondientes dicloruros de metaloceno con sodio metálico:
Nomenclatura, estructura y hapticidad
En analogía con el primer representante de esta clase de sustancias, el ferroceno, solo los complejos metálicos de bis (ciclopentadienilo) de los elementos del subgrupo en los que los anillos de ciclopentadienilo están dispuestos en forma coplanaria y, por lo tanto, forman una estructura sándwich clásica con el átomo metálico se denominan metalocenos en el sentido más estrecho según IUPAC (ver más abajo).
Sin embargo, los ligandos de ciclopentadienilo pueden unirse de diferentes maneras, dependiendo del átomo complejo y central; esto se llama hapticidad , representada por la letra minúscula griega η : en una estructura de sándwich clásica, ambos anillos de ciclopentadienilo tienen coordinación η 5 (pentahapto) ; esto corresponde al enlace uniforme más frecuente del átomo metálico central en los 5 átomos de carbono y distancias iguales entre metal y carbono. En el caso de la coordinación η 1 (monohapto), solo se usa un átomo del anillo para el enlace. Los otros elementos estructurales con η 2 (dihapto), η 3 (trihapto) y η 4 (tetrahapto) también existen, pero son mucho más raros. Los metalocenos en el sentido más amplio son todos los compuestos del tipo MCp 2 , incluidos los complejos diméricos o poliméricos, como el titanoceno o el manganoceno o los complejos de los elementos del grupo principal que se desvían de la estructura sándwich.
La estructura sándwich clásica se produce en los metalocenos de la primera fila de metales de transición del vanadio al níquel , el grupo del hierro (hierro, rutenio , osmio ) y algunos otros metales, incluidos los elementos del grupo principal. η 5 , η 5 complejos sándwich pueden ocurrir en dos conformaciones , eclíptica (en congruencia ) y escalonada (en espacio). La barrera de rotación entre los dos conformadores es muy pequeña en el caso de anillos Cp no sustituidos; la energía de activación para ferroceno, rutenoceno y osmoceno está entre 8 y 21 kJ mol -1 .
Los metalocenos de los primeros metales de transición tienden a no formar una estructura sándwich clásica porque son compuestos deficientes en electrones (tienen significativamente menos de 18 electrones de valencia). Al doblar los anillos Cp en un ángulo de 130 °, el átomo de metal central puede transportar hasta tres ligandos adicionales, lo que aumenta el número de electrones de valencia. Un representante bien conocido es el reactivo de Schwartz (ver más abajo), en el que el átomo de circonio está rodeado por un total de cuatro ligandos. Mediante el uso del ligando pentametilciclopentadienilo (Cp * ) más rico en electrones y exigente estéricamente , es posible estabilizar estos complejos reactivos (debido a que son pobres en electrones) en la estructura clásica de sándwich.
Si los anillos de ciclopentadienilo en los metalocenos están unidos por puentes de hidrocarburos, el resultado es la clase de compuestos de metalocenophanes , cuyo primer representante, [4] ferrocenophane, fue desarrollado en 1958 por Arthur Lüttringhaus et al. fue sintetizado.
En el sentido más amplio, el término compuestos de metaloceno también incluye compuestos de medio sándwich que tienen solo un sistema ciclopentadienilo unido a un átomo de metal central mediante enlaces π. La saturación de valencias libres (de electrones) generalmente tiene lugar a través de grupos carbonilo (por ejemplo, tricarbonil (η 5- ciclopentadienil) manganeso ).
Algunos libros de texto también incluyen el uranoceno como una clase compuesta de metalocenos , aunque este no es un bis (ciclopentadienilo) sino un complejo de bis ( ciclooctatetraenilo ) de uranio.
Modelos de accesorios
Regla de los 18 electrones
La regla de los 18 electrones para los elementos del metal de transición es equivalente a la regla del octeto para los elementos del grupo principal y puede usarse para predecir la estabilidad de los compuestos organometálicos. Afirma que las moléculas o complejos organometálicos en los que la suma de los electrones de valencia del metal más los electrones de unión aportados por los ligandos es un total de 18 son particularmente estables. Para Fe (η 5 -C 5 H 5 ) 2 , el número de electrones de valencia viene dado por
La regla de los 18 electrones puede explicar la alta estabilidad del ferroceno, así como la de los cationes de cobaltocenio y rodocenio: las tres moléculas son isoelectrónicas entre sí y tienen 18 electrones de valencia. También se puede explicar la reactividad del rodoceno y el cobaltoceno. Ambos complejos tienen 19 electrones de valencia, lo que significa que pueden oxidarse fácilmente y el rodoceno z. B. es muy difícil de aislar de una solución de rodocenio. A diferencia de la estabilidad, las relaciones de enlace y las estructuras en los complejos organometálicos no pueden explicarse mediante la regla de los 18 electrones.
Teoría del campo cristalino y teoría del campo ligando
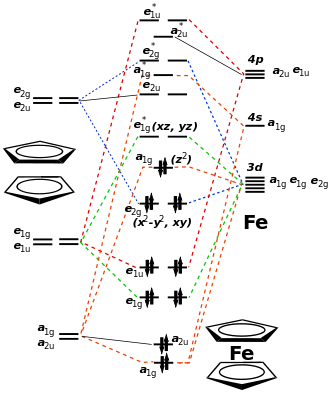
La teoría del campo cristalino proporciona una comprensión cualitativa y la teoría del campo del ligando permite predicciones cuantitativas sobre las propiedades de las sales o complejos de metales de transición. Ambas teorías explican la estructura, el color y el magnetismo de estas sustancias. Ambas teorías consideran cómo los orbitales d del centro complejo están influenciados energéticamente por los ligandos. En un átomo central sin complejos, todos los orbitales d están energéticamente degenerados, es decir, es decir, todos tienen la misma energía. Cuanto más fuerte interactúa un ligando con un orbital d, más energéticamente se desestabiliza (eleva), lo que conduce a una división energética de los orbitales d. Con los metalocenos hay una división 2-1-2: los orbitales en el plano xy ( d xy y d x 2 -y 2 ) apenas interactúan con los ligandos Cp y, por lo tanto, se ven favorecidos energéticamente. El orbital d z 2 solo interactúa con una parte y se encuentra en el medio. Los orbitales d xz y d yz , que apuntan completamente a los anillos, son los más desestabilizados .
Teoría de los orbitales moleculares
Ni la regla de los 18 electrones ni la teoría del campo cristalino por sí solas pueden explicar completamente las propiedades del ferroceno. Solo con el desarrollo de la teoría de los orbitales moleculares ( teoría MO) fue posible explicar la estructura y estabilidad del ferroceno en un modelo.
En la teoría MO, como en la teoría del campo de cristal o ligando, se consideran las interacciones de los orbitales metálicos con los orbitales del ligando. El resultado es un diagrama de orbitales moleculares que contiene orbitales enlazantes, no enlazantes y antienlazantes. Como en la teoría del campo cristalino, la división energética de los orbitales resulta de la interacción entre los orbitales del metal y del ligando. Si, por ejemplo, un orbital ligando del anillo Cp y un orbital d del metal interactúan, surgen dos nuevos orbitales moleculares (OM), que se dividen energéticamente en un OM de unión y otro antienlazante. La fuerza de la división (el aumento energético en un MO y la disminución en el otro MO) es mayor, cuanto más fuerte es la interacción (superposición espacial) entre el ligando y el orbital metálico. Si no hay interacción, el orbital correspondiente no cambia energéticamente y se produce un orbital no vinculante. En la teoría MO, también, los orbitales que apuntan en la dirección de los ligandos son los que están más fuertemente influenciados. Mientras más electrones estén ocupados los OM de unión, más fuerte será el enlace entre el metal y el ligando y más estable se volverá el complejo. Todos los MO de unión están ocupados por 18 electrones de valencia y el complejo tiene la mayor estabilidad.
El gráfico opuesto muestra el diagrama MO del ferroceno, que está ocupado por 18 electrones. Los diagramas de MO de otros complejos sándwich se ven básicamente similares, aunque los niveles de energía individuales de los orbitales difieren de un metal a otro. En el cobaltoceno y el níquelceno, los orbitales e * 1g antienlazantes están ocupados por uno o dos electrones desapareados, lo que conduce a una desestabilización del enlace M-Cp y un ensanchamiento de la distancia MC (Fe = 204 pm, Co = 211 pm, Ni = 218 horas). Si cambia la geometría del complejo o la carga del átomo central, esto también puede invertir el orden de los orbitales moleculares.
propiedades
Metalocenos de subgrupo
Los complejos de diciclopentadienilo existen en un gran número de elementos de los grupos 4 a 12 ( elementos de subgrupo ). Solo los compuestos del grupo 8 son complejos de 18 electrones y, por lo tanto, electrónicamente (particularmente) estables. Los complejos de diciclopentadienilo de los otros grupos no cumplen la regla de los 18 electrones, lo que significa que son significativamente más inestables o reactivos y no siempre forman una estructura de sándwich ideal. Los complejos deficientes de electrones de los grupos 4 a 7 se esfuerzan por compensar su deficiencia de electrones con ligandos adicionales. Sin más reactivos, esto se puede realizar mediante dimerización u oligomerización . Los complejos ricos en electrones de los grupos 9 a 12, por otro lado, se esfuerzan por reducir su exceso de electrones . Esto se puede hacer por oxidación o reduciendo la hapticidad de un ligando.
Desde el cuarto período, los metalocenos del vanadio al níquel existen como compuestos aislables. Todos estos son isomorfos y tienen un punto de fusión de 173 ° C. A partir del quinto período solo los metalocenos de rutenio y rodio y del sexto período solo el osmoceno son compuestos aislables. La siguiente tabla ofrece una descripción general de los metalocenos o complejos de diciclopentadienilo previamente conocidos de los elementos del subgrupo:
| grupo | Cuarto | 5 | Sexto | Séptimo | Octavo | 9 | 10 | 11 | 12 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
Electrones de valencia |
14 | 15 | dieciséis | 17 | 18 | 19 | Vigésimo | 21 | 22 | ||
| Cuarto período | |||||||||||
| Abreviatura Nombre Color Punto de fusión Punto de ebullición Distancia de enlace M-C |
"TiCp 2 " Verde de titanoceno 200 ° C (descomp.) ... ... |
VCp 2 violeta vanadoceno 167 ° C … 227 pm |
CrCp 2 rojo cromoceno 173 ° C … 215 pm |
MnCp 2 Marrón manganoceno 173 ° C 245 ° C 211 pm |
FeCp 2 ferroceno naranja 173 ° C 249 ° C 204 pm |
CoCp 2 cobaltoceno violeta-negro 174 ° C … 211 pm |
NICP 2 niqueloceno verde 173 ° C ... 218 pm |
"ZnCp 2 " zincocene incoloro ... ... ... |
|||
| 5to período | |||||||||||
| Abreviatura Nombre Color Punto de fusión Punto de ebullición Distancia de enlace M-C |
"ZrCp 2 " zirconoceno ... ... ... ... |
"NbCp 2 " amarillo nioboceno ... ... ... |
MoCp 2 molibdoceno negro ... ... ... |
RuCp 2 rutenoceno amarillo claro 195–200 ° C … 221 pm |
RhCp 2 Amarillo rodoceno 174 ° C ... ... |
"CdCp 2 " Cadmocen ... ... ... ... |
|||||
| Sexto período | |||||||||||
| Abreviatura Nombre Color Punto de fusión Punto de ebullición Distancia de enlace M-C |
"TaCp 2 " tantaloceno ... ... ... ... |
"WCp 2 " Wolframocen amarillo o verde ... ... ... |
ReCp 2 renoceno ... ... ... ... |
OsCp 2 blanco osmoceno 226–228 ° C … 219 pm, 222 pm |
IrCp 2 Iridocen ... ... ... ... |
"PtCp 2 " Platinoceno ... ... ... ... |
"HgCp 2 " Mercuroceno ... ... ... ... |
||||
Notas A:
- ↑ número calculado de electrones de valencia en un complejo metálico η 5 , η 5 -Cp 2 .
- ↑ Si la abreviatura está entre comillas, no es un metaloceno clásico (por ejemplo, no hay estructura de sándwich).
- ↑ a b c d e f No existe como un complejo sándwich (puro).
- ↑ a b cobre, oro: hasta ahora solo calculado.
- ↑ solo se puede detectar con estabilización de matriz.
- ↑ El tecnecio es un elemento radiactivo.
- Estructuras de metalocenos de subgrupos seleccionados
Grupo 4: El titanoceno , al igual que el circonoceno homólogo , solo existe como dímero a temperatura ambiente, en el que dos ligandos de ciclopentadienilo como fulvaleno y los dos átomos de titanio también están conectados entre sí a través de dos enlaces de hidrógeno de 2 electrones y 3 centros . Cada átomo de titanio tiene 16 electrones de valencia. Con ligandos más exigentes estéricamente, como pentametilciclopentadienilo (Cp * ) , se puede sintetizar el complejo monomérico de 14 electrones TiCp * 2 , que está presente en una conformación escalonada. Para investigar las reacciones del titanoceno libre, esto se puede hacer in situ, por. B. a partir de TiCp 2 Cl 2 por reacción con magnesio, se puede sintetizar amalgan de litio o sodio.
Grupo 5: El vanadoceno es un sólido paramagnético cristalino de color púrpura que, como complejo de 15 electrones, es inestable. El nioboceno no existe como un complejo sándwich monomérico a temperatura ambiente, pero se dimeriza como [NbH (C 5 H 5 ) (C 5 H 4 )] 2 . En el dímero, cada átomo de niobio tiene, además de los dos η 5 ligandos Cp, un η adicional 1 enlace a un átomo de carbono del anillo del otro átomo central y una más hidruro de ligando. Junto con el enlace adicional de metal niobio-niobio, cada átomo de metal tiene 18 electrones de valencia.
Grupo 6: El cromoceno es un sólido cristalino rojo que es muy reactivo en el aire y en relación con el agua y, en determinadas circunstancias, puede inflamarse espontáneamente al entrar en contacto con el aire. Aplicado a un portador de silicato, se utiliza como catalizador en la polimerización de etileno y otros 1-alquenos. ¿Cómo el molibdoceno puede Wolframocen solo como un intermedio reactivo tal. B. fotoquímicamente de WCp 2 H 2 o térmicamente de WCp 2 (H) CH 3 . Ambos complejos no son estables como monómeros a temperatura ambiente y se dimerizan con la formación de diferentes complejos binucleares isoméricos.
Grupo 7: El manganoceno es un sólido marrón, rosado por encima de 158 ° C, con propiedades magnéticas inusuales . Debido a la configuración favorable d5 de alto espín (cada orbital d está ocupado por un electrón), no se puede reducir a Mn + para obtener la configuración favorable de 18 electrones. El manganoceno es polimérico en el sólido y cada manganeso está rodeado por tres ligandos ciclopentadienilo. Dos de los tres ligandos están conectados a dos centros de manganeso cada uno, mientras que el tercero solo está unido a un átomo de manganeso. Los ligandos de ciclopentadienilo puente no son simétricos entre los átomos de manganeso. El renoceno se puede producir, aislar e investigar mediante fotólisis de Re (C 5 H 5 ) 2 H en una matriz de nitrógeno y argón a 12 K. En estas condiciones, el complejo es monomérico y tiene una estructura de sándwich.
Grupo 8: el ferroceno , el único metaloceno estable al aire, es un complejo de electrones diamagnéticos de 18 valencia en el que el átomo de hierro está bien protegido estéricamente por los anillos de Cp. Cuando se calienta en una ampolla de vidrio evacuado, se descompone por encima de 550 ° C . Debido a su extraordinaria estabilidad y su comportamiento aromático (los anillos de ciclopentadienilo son accesibles para reacciones de sustitución electrofílica) el ferroceno fue y es objeto de numerosos estudios. En comparación con el ferroceno y el rutenoceno, el osmoceno es menos reactivo hacia la sustitución aromática electrófila, pero muestra la mayor tendencia a formar aductos con ácidos de Lewis .
Grupo 9: Los complejos de 19 electrones cobaltoceno , rodoceno e iridoceno se oxidan fácilmente al catión metalocenio de 18 electrones correspondiente. La tendencia a oxidarse es tan grande que los haluros orgánicos son suficientes:
En consecuencia, el cobaltoceno sirve como agente reductor de 1 electrón y puede usarse como indicador para sistemas redox anhidros. El catión cobaltociunio es tan estable que el complejo de di (metilciclopentadienilo) no es destruido por el ácido nítrico , sino que el grupo metilo del anillo aromático se oxida al grupo ácido carboxílico. El rodoceno solo es estable a temperaturas superiores a 150 ° C o cuando se enfría a la temperatura del nitrógeno líquido (-196 ° C). A temperatura ambiente (25 ° C), el rodoceno en acetonitrilo se convierte en menos de 2 segundos por dimerización (combinación) en [Rh (C 5 H 5 ) 2 ] 2 , un complejo de electrones diamagnéticos de 18 valencia en el que dos unidades de rodoceno están conectadas a entre sí a través de anillos de ciclopentadienilo. El rodoceno dímero [Rh (C 5 H 5 ) 2 ] 2 es un sólido amarillo.
Grupo 10: El níquelceno es un sólido cristalino de color verde oscuro que es tolerablemente resistente al aire y se puede oxidar fácilmente. El palladoceno y el platinoceno , los otros dos complejos del grupo 10, aún no se conocen, solo se podrían sintetizar las correspondientes indicaciones con la ayuda de ligandos voluminosos como el Cp * .
Grupo 11: Todavía no se pudieron producir metalocenos de cobre , plata y oro ; Cu (C 5 H 5 ) 2 y Au (C 5 H 5 ) 2 solo se han calculado hasta ahora.
Grupo 12: El zinkoceno fue descrito por primera vez en 1969 por Ernst Otto Fischer. Se polimeriza en una estructura de cadena en la que los anillos de ciclopentadienilo alternados y los átomos de zinc están unidos entre sí y cada átomo de zinc tiene un anillo de ciclopentadienilo terminal adicional. Cadmocen fue descrito por primera vez por Jörg Lorberth en 1969. Debido a su insolubilidad en solventes no polares y la alta temperatura de descomposición de> 250 ° C, se asumió que también tiene una estructura polimérica. Mediante el uso de sustituyentes voluminosos tales como isopropilo o terc-butilo, Dirk Bentz pudo preparar derivados de cadmoceno monoméricos que tienen una coordinación η 1 , η 1 o η 1 , η 2 de los anillos.
La estabilidad relativa de los metalocenos del subgrupo se puede determinar comparando los potenciales redox de los cationes cargados individualmente . Los datos de la siguiente lista se determinan frente a un electrodo de calomelanos saturado en acetonitrilo :
- [Fe (C 5 H 5 ) 2 ] + / [Fe (C 5 H 5 ) 2 ] +0,38 V
- [Co (C 5 H 5 ) 2 ] + / [Co (C 5 H 5 ) 2 ] - 0,94 V
- [Rh (C 5 H 5 ) 2 ] + / [Rh (C 5 H 5 ) 2 ] −1,41 V
Estos datos muestran la estabilidad del ferroceno neutro, así como los cationes cobaltocenio y rodocenio. El rodoceno tiene un efecto reductor de alrededor de 500 mV más que el cobaltoceno, lo que también significa que se puede oxidar más fácilmente y, en consecuencia, es menos estable. Investigaciones polarográficas anteriores sobre perclorato de rodocenio a un valor de pH neutro mostraron una señal a -1,53 V en un electrodo de mercurio que gotea (en comparación con un electrodo de calomelanos saturado), correspondiente a la formación de rodoceno en solución; sin embargo, los investigadores no pudieron aislar el rodoceno neutro. En el mismo estudio, intentaron detectar el iridoceno a partir de sales de iridocenio en condiciones oxidantes, pero esto no tuvo éxito ni siquiera a valores de pH elevados. Estos resultados indican que el rodoceno es muy inestable, pero también indican que el iridoceno es aún más inestable.
Complejos de ciclopentadienilo de las tierras raras
Los metales del grupo 3 ( tierras raras ) no suelen formar complejos sándwich clásicos. Los complejos de fórmula general MCp 3 se obtienen por reacción de los correspondientes haluros con ciclopentadienil sódico . Geoffrey Wilkinson y JM Birmingham sintetizaron y describieron una serie completa de complejos de ciclopentadienilo de las tierras raras en 1956:
| M (C 5 H 5 ) 3 M = |
color | Punto de fusion | Color (derretido) |
|---|---|---|---|
| Escandio | color pajizo | 240 | rojo |
| itrio | de color amarillo pálido | 295 ° C | amarillo verdoso |
| Lantano | incoloro | 395 ° C | incoloro |
| cerio | naranja amarillo | 435 ° C | amarillo |
| Praseodimio | verde tenue | 415 ° C | verde |
| Neodimio | rojo azul | 380 ° C | rojo azul |
| Samario | naranja | 415 ° C | naranja |
| Gadolinio | amarillo | 350 ° C | amarillo |
| Disprosio | amarillo | 302 ° C | amarillo |
| Erbio | rosado | 285 ° C | rosado |
| iterbio | verde oscuro | 273 ° C | verde |
Notas B:
Todos los complejos de ciclopentadienilo de tierras raras del tipo MCp 3 tienen propiedades químicas similares. No son solubles en éter de petróleo , ciclohexano y benceno y son ligeramente solubles en piridina , THF , etilenglicol dimetiléter y 1,4-dioxano . Con agua se descomponen rápidamente en hidróxido de metal y ciclopentadieno. También se descomponen rápidamente al contacto con el aire. Reaccionan rápida y cuantitativamente con el cloruro de hierro (II) en THF para formar ferroceno. Tanto el comportamiento químico como las propiedades físicas como la susceptibilidad magnética (que se encuentran próximas a los iones correspondientes) implican un carácter iónico de los complejos.
Sin embargo, también se pueden sintetizar complejos de MCp 2 de tierras raras. De estos, los complejos de lantanoceno (II) de samario, europio e iterbio, que llevan el nombre de los lantánidos , son los más conocidos. Éstos tienden a formar complejos donantes del tipo Cp 2 (THF) 2 con disolventes como el THF . En 1964, EO Fischer sintetizó los complejos EuCp 2 e YbCp 2 en amoníaco líquido y los purificó por sublimación. El SmCp * 2 sin disolventes fue elaborado por William J. Evans en 1984. En 1986 William J. Evans pudo demostrar mediante análisis de estructuras de rayos X que SmCp * 2 y EuCp * 2 tienen una estructura en sándwich en ángulo con un ángulo Cp-M-Cp de 140 °.
Complejos ciclopentadienilo de actínidos
Los metales de la serie de actinoides , como los metales de las tierras raras, no forman complejos sándwich clásicos. Los complejos de Cp 3 An y sus aductos de tetrahidrofurano (Cp 3 An · thf) se obtuvieron entre 1965 y 1974 mediante metátesis de sal con ciclopentadienil sódico o mediante transmetalación con BeCp 2 o MgCp 2 .
| M (C 5 H 5 ) 3 M = |
color | Punto de fusion |
|---|---|---|
| Torio | verde | - |
| uranio | marrón | > 200 ° C |
| neptunio | marrón | - |
| plutonio | verde | 180 ° C (descomposición) |
| Americio | color carne | 300 ° C (descomposición) |
| Curio | incoloro | - |
| Berkelio | color ambar | - |
| Californio | rojo | - |
Nota C:
- ↑ Compuesto no completamente caracterizado
Los compuestos especificados también se pueden preparar mediante reducción química de los complejos de haluro tetravalente Cp 3 AnX (X = haluro ), por ejemplo con amalgama de sodio :
Metalocenos alcalinos
El primer compuesto de ciclopentadienilo alcalino, ciclopentadienida de potasio, fue producido por Johannes Thiele ya en 1901 , pero su estructura no fue aclarada hasta 1997 por RE Dinnebier y F. Olbrich. En el cristal, los iones de potasio y Cp forman una estructura de cadena lineal en la que los anillos de Cp forman un ángulo entre sí y los átomos de potasio se colocan en el centro por encima de los anillos. Se pueden encontrar estructuras similares en los cristales de RbCp y CsCp. Por el contrario, LiCp y NaCp forman una cadena lineal ideal con una disposición paralela de los anillos de Cp. Los ángulos de enlace medidos a los anillos Cp en LiCp y NaCp son 180 ° y disminuyen en los homólogos más pesados : potasio 138 °, rubidio 132 ° y cesio 130 °.
En el ion litiocenio, los dos anillos Cp adoptan una conformación escalonada con una distancia Li-Cp de 201 pm. Debido a la relación oblicua en la tabla periódica , los complejos de litoceno son similares en estructura y reacciones al magnesoceno que se describe a continuación. Además del enlace iónico, los complejos de organolitio tienen un componente claramente covalente, lo que puede conducir a una fuerte distorsión de la estructura del carbanión . Este componente covalente decrece marcadamente en los homólogos más pesados y ya se encuentra un enlace casi exclusivamente iónico en el caso del potasio.
Recientemente se han descrito los primeros complejos de natrocenio. Su aislamiento se logra mediante el uso de éteres corona , que forman cationes complejos con iones de sodio . Aún no se conocen complejos sándwich de los homólogos más pesados potasio, rubidio y cesio.
Metalocenos alcalinotérreos
Los complejos de bisciclopentadienilo se sintetizaron a partir de todos los elementos del grupo 2 ( metales alcalinotérreos ). El beriloceno fue sintetizado por primera vez en 1959 por Ernst Otto Fischer a partir de cloruro de berilio y ciclopentadienilo alcalino. El magnesoceno fue sintetizado independientemente por Ernst Otto Fischer y Geoffrey Wilkinson ya en 1954. Puede obtenerse desproporcionando CpMgBr o haciendo reaccionar magnesio metálico con ciclopentadieno a 500 ° C. Los complejos de bisciclopentadienilo de calcio , estroncio y bario también fueron descritos por primera vez por Ernst Otto Fischer en 1961. Pueden obtenerse haciendo reaccionar calcio metálico o estroncio con ciclopentadieno en THF o DMF o haciendo reaccionar los correspondientes hidruros de calcio, estroncio y bario con ciclopentadieno: La cocondensación de bario metálico con ciclopentadieno a -196 ° C da un rendimiento casi cuantitativo.
De los metalocenos alcalinotérreos, solo el magnesoceno tiene la estructura clásica de sándwich. E. Weiß pudo demostrar que el magnesoceno en el cristal tiene una conformación escalonada con una distancia de Mg-C de 230 pm ; por otro lado, según A. Haland, el enlace metal-Cp se ensancha en la fase gaseosa y la molécula tiene una conformación eclíptica. Todavía no está claro si el enlace entre el metal y el anillo Cp es más de tipo covalente o más iónico . La estructura sándwich, que es análoga al ferroceno , no sugiere necesariamente un enlace covalente; también podría explicarse por las interacciones de van der Waals . La conductividad eléctrica en el líquido de amoníaco , la violenta reacción de hidrólisis y el 13 cambio de C-RMN de 108 ppm (para comparación LICP = 103,6 ppm; NaCp = 103,4 ppm, FeCp 2 = 68,2) hablar por el carácter más bien iónico ppm). Por otro lado, los datos de RMN de 25 Mg tienden a sugerir un enlace en gran parte covalente.
El beriloceno presenta diferentes geometrías moleculares según el estado físico. En estado sólido, muestra una estructura de sándwich deslizada , los anillos están desplazados entre sí: un anillo está coordinado η 5, el segundo solo η 1 (distancia Be-Cp: 181 pm). En la fase gaseosa, ambos anillos parecen estar coordinados η 5 . De hecho, un anillo está significativamente más lejos que el otro (190 y 147 pm) y la aparente coordinación η 5 se debe a una rápida fluctuación en el enlace. La razón de la estructura η 5 , η 1 es que los orbitales del berilloceno solo pueden estar ocupados por un máximo de 8 electrones de valencia.
El carácter iónico de los metalocenos alcalinotérreos aumenta con el aumento del número atómico. En el cristal, Ca (C 5 H 5 ) 2 tiene una estructura polimérica, con cada átomo central rodeado por cuatro ligandos Cp. Los anillos Cp tienen diferente hapticidad (η 5 -, η 5 -, η 3 -, η 1 -). Si se usa pentametilciclopentadienilo (Cp * ) como ligando , las estructuras de las moléculas aisladas se pueden determinar en la fase gaseosa por difracción de electrones. Sorprendentemente, esto muestra que las moléculas tienen una estructura en ángulo en la que el ángulo aumenta con el tamaño del átomo central: Mg = 180 °, Ca = 154 °, Sr = 149 °, Ba = 148 °. Otros estudios de Richard Blom et al. mostró en el caso de los complejos de pentametilciclopentadienilo CaCp * 2 e YbCp * 2 que los planos están inclinados entre sí en 20 °. Se utilizaron varios modelos para la pesca con caña:
- Modelo electrostático: los ligandos negativos alteran la simetría esférica de la capa de electrones en el átomo central.
- Interacción de Van der Waals: la fuerza impulsora de la flexión es la ganancia en la atracción de van der Waals entre los ligandos.
- (n-1) afectación del orbital d - formación de orbitales híbridos ds
- métodos ab-initio MO
Si se utilizan ligandos más exigentes estéricamente, tales como pentaisopropilciclopentadienilo (C 5 i Pr 5 ), la flexión se cancela de nuevo (ejemplo: Ba (C 5 i Pr 5 ) 2 : 180 °).
El magnesoceno y los homólogos más pesados forman aductos correspondientes con bases de Lewis que contienen oxígeno, nitrógeno y fósforo . El magnesoceno forma complejos 1: 1 o 1: 2 con amoniaco o aminas , que en el caso de aminas primarias o secundarias pueden aislarse y examinarse cristalográficamente . En estos aductos, la hapticidad de un anillo Cp cambia de η 5 a η 2 . Con 2 moléculas de THF , por otro lado, se forma un complejo η 5 , η 1 . El correspondiente complejo de baroceno con 2 THF es entonces de nuevo un complejo η 5 , η 5 .
usar
Debido a sus diferentes propiedades químicas y reactividad, los metalocenos y derivados de metaloceno se utilizan ampliamente en la investigación y en la práctica. El magnesoceno se utiliza en el laboratorio para transferir ligandos de ciclopentadienilo a otros metales.
Como fuente de metal
Se utilizan metalocenos térmicamente o fotoquímicamente inestables como fuente de vapor metálico de alta pureza. El magnesoceno se utiliza para recubrir nanopartículas y en el proceso ALE (epitaxia de capa atómica), en el que z. B. Se utilizan LED verdes o azules . También se utiliza como dopante en la fabricación de semiconductores dopados con p en el proceso CVD (deposición química de vapor). Barocen se puede utilizar en el proceso ALD (deposición de capa atómica) para aplicar capas delgadas de BaTiO 3 para resistencias y condensadores. Para reducir el consumo, se puede agregar ferroceno diesel o aceite de calefacción para lograr una mejor unión de oxígeno y, por lo tanto, una combustión más efectiva y limpia (reducción de partículas de hollín ).
Como catalizadores de polimerización
Con mucho, la aplicación más importante hoy en día para los metalocenos y sus derivados es su uso como catalizadores de polimerización para la producción de poliolefinas.
Los catalizadores de Ziegler-Natta se han utilizado para la polimerización de olefinas como el etileno o el propileno a bajas presiones y temperaturas desde la década de 1950 . En un mecanismo de adición-inserción de múltiples etapas, la olefina se une primero a un complejo de organotitanio y luego se incorpora al enlace titanio-carbono. Luego se agrega la siguiente olefina al punto de coordinación que se libera y la reacción en cadena continúa mediante la incorporación de la olefina en el enlace titanio-carbono. Los catalizadores clásicos de Ziegler-Natta son catalizadores mixtos que consisten en un compuesto del grupo principal organometálico de los grupos I, II o III (por ejemplo, trietilaluminio ) y un compuesto de metal de transición, principalmente de los grupos IV a VI (por ejemplo, tetracloruro de titanio ). Sin embargo, tienen el inconveniente decisivo de que se suelen utilizar como catalizadores heterogéneos sobre un material de soporte, ya que no son solubles en disolventes orgánicos. Como resultado, además de las propiedades reales del catalizador, también juegan un papel las propiedades del material de soporte, la velocidad de difusión de la olefina y otras reacciones de adsorción. En 1982, Patricia Wilson descubrió que el Lu -Cp * 2 CH 3 soluble también actúa como catalizador de polimerización para etileno y propileno sin un co-iniciador.
En 1980 Hansjörg Sinn y Walter Kaminsky describieron las reacciones de polimerización catalítica de mezclas de dihaluros de metaloceno (tipo 1) con metilaluminoxano (MAO). Estos catalizadores de Kaminsky permiten la polimerización de mezclas de etileno, propileno u olefinas con muy alta productividad y selectividad. Mientras que los metalocenos con un cocatalizador de alquil aluminio convencional muestran solo una baja actividad, la presencia de metilaluminoxano en exceso aumenta su reactividad en un factor de 10,000 y más, haciéndolos cien veces más activos que los catalizadores tradicionales de Ziegler-Natta. Los catalizadores de Kaminsky también son solubles en hidrocarburos y, a diferencia de los catalizadores de Ziegler-Natta, por lo tanto pueden usarse directamente en solución. Los catalizadores Kaminsky basados en circonoceno pueden polimerizar hasta 100 toneladas de etileno por gramo de circonio, con un tiempo de inserción del orden de 10-5 s .
Cinco años después, Walter Kaminsky y Hans-Herbert Brintzinger describieron que cuando se utilizan ansa-metalocenos de tipo 2 ( ansa-metalocenos asimétricos en C 2 ), se puede producir polipropileno con una disposición estrictamente isotáctica . Ampliando los residuos orgánicos en los anillos Cp (como en el tipo 3) y / o variando los átomos de puente, la actividad y la selectividad se pueden influir específicamente y la distribución del peso molecular de los polímeros resultantes se puede optimizar dentro de límites estrechos.
El magnesoceno y los compuestos bisciclopentadienílicos de calcio y estroncio se pueden usar como catalizador de polimerización, para. B. para el éster metílico del ácido metacrílico (MMA).
En terapia tumoral
Muchos derivados de metaloceno de los primeros metales de transición no tienen una estructura de sándwich clásica. En cambio, el eje Cp-M-Cp a menudo tiene un ángulo de alrededor de 130 °, ya que transportan hasta tres ligandos adicionales. Como resultado, su átomo central es más fácilmente accesible y más reactivo para los compañeros de reacción, lo que también puede notarse en una mayor bioactividad , entre otras cosas . Los derivados titanoceno, molibdoceno, nioboceno, vanadoceno y renoceno del tipo MCp 2 Cl 2 tienen un efecto citostático . Los estudios han demostrado que, en particular, los derivados del dicloruro de titanoceno TiCp 2 Cl 2 en la terapia tumoral son más efectivos que el cisplatino con una toxicidad significativamente menor. Además, esta eficacia también se muestra en los tipos de cáncer, que pueden desarrollar resistencia al cisplatino en el curso de la terapia, lo que dificulta la terapia adicional si reaparecen las células cancerosas. Otros estudios demostraron que los complejos catiónicos de dicloruro de nioboceno y dicloruro de molibdoceno tienen una eficacia aún más mejorada en comparación con el dicloruro de titanoceno. Hasta la fecha, no se ha aprobado ningún metaloceno para el tratamiento del cáncer . Los estudios clínicos del metaloceno oncológicamente más prometedor, el dicloruro de titanoceno, finalizaron en la fase II, pero hasta el momento no se ha realizado ningún estudio de fase III debido a la actividad insuficiente.
En tecnología de sensores
Debido a la excelente estabilidad estructural del ferroceno, tanto en su forma neutra como catión de ferrocenio, el ferroceno es ideal tanto para medir potenciales redox como como socio en reacciones redox. Si arregla z. B. una combinación de un derivado de ferroceno con la enzima glucosa oxidasa en la superficie de un electrodo, se puede medir una corriente cuando la glucosa está presente en un fluido fisiológico cuando se aplica un potencial eléctrico . En comparación con una curva de calibración, z. B. en diabéticos determina directamente el contenido de glucosa en la sangre. Si un grupo funcional que forma complejos cationes se une al ferroceno , el comportamiento redox de este derivado de ferroceno cambia en presencia de un catión. Si el grupo funcional reacciona (exclusivamente) con un determinado catión, se obtiene un sensor selectivo para este catión. Más recientemente, también se han utilizado derivados de ferroceno en óptica no lineal .
literatura
- AF Holleman , E. Wiberg , N. Wiberg : Libro de texto de química inorgánica . 101ª edición. Walter de Gruyter, Berlín 1995, ISBN 3-11-012641-9 , págs. 1699-1703.
- Walter Kaminsky : metalocenos . En: Enciclopedia de química industrial de Ullmann . 15 de junio de 2006, doi : 10.1002 / 14356007.b16_b36.pub2 (inglés).
- Anthony F. Hill: Química de metales de organotransición . Real Sociedad de Química , 2002, ISBN 978-0-85404-622-5 , págs. 161 f ., doi : 10.1039 / 9781847551597 . (para explicar el término "ansa-metalocenos")
enlaces web
Evidencia individual
- ↑ Entrada sobre ciclopentadienilo. En: Römpp Online . Georg Thieme Verlag, consultado el 8 de junio de 2014.
- ^ Comunicado de prensa: El Premio Nobel de Química 1973. La Real Academia Sueca de Ciencias, 1973, consultado el 28 de diciembre de 2011 .
- ↑ a b T. J. Kealy, PL Pauson: Un nuevo tipo de compuesto orgánico de hierro . En: Naturaleza . cinta 168 , no. 4285 , 1951, págs. 1039-1040 , doi : 10.1038 / 1681039b0 .
- ^ A b c Peter L. Pauson: Ferroceno: cómo empezó todo . En: J. Organomet. Chem. Band 637-639 , 2001, págs. 3-6 ( caltech.edu [PDF; 103 kB ]).
- ^ A b Samuel A. Miller, John A. Tebboth, John F. Tremaine: Dicyclopentadienyliron . En: J. Chem. Soc. 1952, pág. 632-635 , doi : 10.1039 / JR9520000632 .
- ↑ a b c d F.Albert Cotton: química del metal ciclopentadienilo en el Grupo Wilkinson, Harvard, 1952-1955 . En: J. Organomet. Chem. Band 637-639 , diciembre de 2001, págs. 18-26 , doi : 10.1016 / S0022-328X (01) 01130-5 .
- ↑ Geoffrey Wilkinson, M. Rosenblum, MC Whiting, RB Woodward: La estructura del hierro bis-ciclopentadienilo . En: JA Chem. Soc. 1952, pág. 2125-2126 , doi : 10.1021 / ja01128a527 .
- ↑ Pierre Laszlo, Roald Hoffmann: Ferrocene: ¿una historia objetiva o una historia de Rashomon? En: Angewandte Chemie . cinta 112 , no. 1 , 2000, págs. 127-128 , doi : 10.1002 / (SICI) 1521-3757 (20000103) 112: 1 <127 :: AID-ANGE127> 3.0.CO; 2-2 .
- ^ PF Eiland, R. Pepinsky: examen de rayos X de hierro bisciclopentadienilo . En: J. Am. Chem. Soc. cinta 74 , no. 19 , 1952, págs. 4971 , doi : 10.1021 / ja01139a527 .
- ↑ J. Dunitz, L. Orgel, A. Rich: La estructura cristalina del ferroceno . En: Acta Crystallographica . cinta 9 , no. 4 , 1956, págs. 373-375 , doi : 10.1107 / S0365110X56001091 .
- ^ RB Woodward, M. Rosenblum, MC Whiting: UN NUEVO SISTEMA AROMÁTICO . En: J. Am. Chem. Soc. cinta 74 , no. 13 , 1952, págs. 3458-3459 , doi : 10.1021 / ja01133a543 .
- ^ G. Wilkinson: La preparación y algunas propiedades de las sales de rutenoceno y rutenicinio . En: J. Am. Chem. Soc. cinta 74 , no. 23 , 1952, págs. 6146-6147 , doi : 10.1021 / ja01143a538 .
- ↑ G. Wilkinson, PL Puason, JM Birmingham, FA Algodón: derivados de bis-ciclopentadienilo de algunos elementos de transición . En: J. Am. Chem. Soc. cinta 75 , no. 4 , 1953, págs. 1011-1012 , doi : 10.1021 / ja01100a527 .
- ^ EO Fischer, R. Jira: Di-ciclopentadienil-níquel. En: Revista de Investigación de la Naturaleza B . 8, 1953, págs. 217-219 ( PDF , texto completo gratuito).
- ^ EO Fischer, R. Jira: Di-ciclopentadienil-cobalto (II). En: Revista de Investigación de la Naturaleza B . 8, 1953, págs. 327-328 (en línea ).
- ↑ EO Fischer, W. Hafner: Di-ciclopentadienil-cromo. En: Revista de Investigación de la Naturaleza B . 8, 1953, págs. 444-445 (en línea ).
- ↑ a b c F.A. Algodón, RO Whipple, G. Wilkinson: Compuestos bis-ciclopentadienilo de rodio (III) e iridio (III) . En: J. Am. Chem. Soc. cinta 75 , no. 14 , 1953, págs. 3586-3587 , doi : 10.1021 / ja01110a504 .
- ^ A b G. Wilkinson: Compuestos ciclopentadienilo de cromo, molibdeno y tungsteno . En: J. Am. Chem. Soc. cinta 76 , no. 1 , 1954, pág. 209–211 , doi : 10.1021 / ja01630a053 .
- ^ JM Birmingham, AK Fischer, G. Wilkinson: La reducción de compuestos de bis-ciclopentadienilo . En: Ciencias Naturales . cinta 42 , no. 4 , 1955, págs. 96 , doi : 10.1007 / BF00617242 .
- ^ G. Wilkinson, JM Birmingham: hidruro de bisciclopentadienilrenio, un nuevo tipo de hidruro . En: J. Am. Chem. Soc. cinta 77 , no. 12 , 1955, págs. 3421–3422 , doi : 10.1021 / ja01617a098 .
- ↑ G. Wilkinson, JM Birmingham: Compuestos de bis-ciclopentadienilo de Ti, Zr, V, Nb y Ta . En: J. Am. Chem. Soc. cinta 76 , no. 17 , 1954, págs. 4281-4284 , doi : 10.1021 / ja01646a008 .
- ^ L. Friedman, AP Irsa, G. Wilkinson: Espectros de masas de compuestos de metal ciclopentadienilo. Parte I. Compuestos de bis-ciclopentadienilo de V, Cr, Fe, Co, Ni, Re y Ru, y ciclopentadienidas de manganeso y magnesio . En: J. Am. Chem. Soc. cinta 77 , no. 14 , 1955, págs. 3689-3692 , doi : 10.1021 / ja01619a004 .
- ↑ G. Wilkinson, JM Birmingham: compuestos ciclopentadienilo de Sc, Y, La, Ce y algunos elementos lantánidos . En: J. Am. Chem. Soc. cinta 76 , no. 23 , 1954, págs. 6210 , doi : 10.1021 / ja01652a114 .
- ^ A b G. Wilkinson, JM Birmingham: Las ciclopentadienidas de escandio, itrio y algunos elementos de tierras raras . En: J. Am. Chem. Soc. cinta 78 , no. 1 , 1956, pág. 42–44 , doi : 10.1021 / ja01582a009 .
- ^ A b J. M. Birmingham, D. Seyferth, G. Wilkinson: una nueva preparación de compuestos de bis-ciclopentadienil-metal . En: J. Am. Chem. Soc. cinta 76 , no. 16 , 1954, págs. 4179 , doi : 10.1021 / ja01645a038 .
- ↑ J. Huheey, E. Keiter, R. Keiter: Química inorgánica . de Gruyter Verlag, 1993, ISBN 3-11-017903-2 ( página 800 en la búsqueda de libros de Google).
- ^ Didier Astruc: Catálisis y química organometálica . Springer-Verlag, Berlín, Heidelberg 2007, ISBN 978-3-540-46128-9 ( páginas 251-270 en la búsqueda de libros de Google).
- ↑ a b c d e f g Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( páginas 65-71 en la búsqueda de libros de Google).
- ↑ a b c d Erwin Riedel : Química inorgánica moderna . de Gruyter, 2007, ISBN 978-3-11-019060-1 ( página 622 en la búsqueda de libros de Google).
- ↑ a b c d Ernst Otto Fischer, Georg Stölzle: Erdalkali-di-ciclopentadienilos de calcio, estroncio y bario . En: Chem. Ber. cinta 94 , no. 8 , 1961, págs. 2187-2193 , doi : 10.1002 / cber.19610940836 .
- ↑ J. Grobe, BH Schneider, H. Zimmermann: Presentación . En: Z. Anorg. Volumen químico general 481 , no. 10 , 1981, págs. 107-116 , doi : 10.1002 / zaac.19814811012 .
- ↑ a b c d e f Anja Jaenschke: Aductos base de magnesoceno , disertación 2006 (pdf, 6,8 MB).
- ^ AF Holleman , E. Wiberg , N. Wiberg : Libro de texto de química inorgánica . 101ª edición. Walter de Gruyter, Berlín 1995, ISBN 3-11-012641-9 , págs. 1701-1702.
- ↑ Albrecht Salzer : Nomenclatura de compuestos organometálicos de metales de transición . En: Angewandte Chemie . cinta 114 , no. 11 , 2000, págs. 2043-2058 , doi : 10.1002 / 1521-3757 (20020603) 114: 11 <2043 :: AID-ANGE2043> 3.0.CO; 2-3 .
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Libro de texto de química inorgánica . 101ª edición. Walter de Gruyter, Berlín 1995, ISBN 3-11-012641-9 , págs. 1699-1700.
- ^ Didier Astruc : Catálisis y química organometálica . Springer-Verlag, Berlín, Heidelberg 2007, ISBN 978-3-540-46128-9 ( páginas 251-270 en la búsqueda de libros de Google).
- ↑ a b c Didier Astruc: Catálisis y química organometálica . Springer-Verlag, Berlín, Heidelberg 2007, ISBN 978-3-540-46128-9 ( páginas 251-270 en la búsqueda de libros de Google).
- ↑ Ulrich T. Mueller-Westerhoff: [mm] Metalocenophane: síntesis, estructura, propiedades . En: Angewandte Chemie . cinta 98 , no. 8 , 1986, págs. 700-716 , doi : 10.1002 / anie.19860980805 .
- ↑ A. Lüttringhaus , W. Kullick: Ansa-ferroceno . En: Angewandte Chemie . cinta 70 , no. 14 , 1958, pág. 438 , doi : 10.1002 / anie.19580701407 .
- ↑ EO Fischer, W. Pfab: Sobre la estructura cristalina de los compuestos diciclopentadienílicos de hierro divalente, cobalto y níquel . En: Z. Anorg. Volumen químico general 274 , no. 6 , 1953, págs. 316-322 , doi : 10.1002 / zaac.19532740603 .
- ^ RC Mehrotra, A. Singh: Química organometálica: un enfoque unificado . 2ª Edición. New Age International, Nueva Delhi 2007, ISBN 978-81-224-1258-1 ( páginas 261-267 en la Búsqueda de libros de Google).
- ↑ a b c d Piero Zanelli: Teoría, práctica y aplicaciones de la electroquímica inorgánica . Royal Society of Chemistry, 2003, ISBN 0-85404-661-5 ( páginas 159-216 en la búsqueda de libros de Google).
- ↑ a b c d Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( páginas 457-458 en la búsqueda de libros de Google).
- ↑ J. Huheey, E. Keiter, R. Keiter: Química inorgánica . de Gruyter Verlag, 1993, ISBN 3-11-017903-2 ( página 792 en la búsqueda de libros de Google).
- ↑ a b Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( página 452 en la búsqueda de libros de Google).
- ↑ Entrada sobre bis (ciclopentadienil) osmio en ChemicalBook , consultado el 30 de diciembre de 2011.
- ↑ JCA Bobyens, DC Levendis, Michael I. Bruce y Michael L. Williams: Estructura cristalina del osmoceno, Os (η-C 5 H 5 ) 2 . En: Revista de Cristalografía Química . cinta 16 , no. 4 , 1986, págs. 519-524 , doi : 10.1007 / BF01161040 .
- ↑ a b Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( página 459 en la búsqueda de libros de Google).
- ↑ Peter B. Hitchcock, Francesca M. Kerton, Gerard A. Lawless: El esquivo Titanoceno . En: J. Am. Chem. Soc. cinta 120 , no. 39 , 1998, págs. 10264-10265 , doi : 10.1021 / ja981934e .
- ↑ Thomas Janssen: Bis (<eta> 1 , <eta> 5 -pentafulvene) complejos de titanio: reactivos para reacciones selectivas con sustratos ácidos N-H y catalizadores en hidroaminación de alquenos intramoleculares , disertación 2010 (pdf, 7,9 MB).
- ↑ Patente DE4306105A1 : Sistemas catalíticos de cromoceno soportados modificados.
- ↑ Manfred Dieter Lechner, Klaus Gehrke, Eckhard H. Nordmeier: Química macromolecular: un libro de texto para químicos, físicos, científicos de materiales e ingenieros de procesos . 4ª edición. Birkhäuser, Basilea 2010 ( página 93 en la búsqueda de libros de Google).
- ↑ John F. Hartwig, Xiaoming He: Reactividad de Wolframocene hacia los enlaces BB y BH en comparación con los enlaces CH . En: Angewandte Chemie . cinta 108 , no. 3 , 1996, pág. 352-354 , doi : 10.1002 / anie.19961080321 .
- ↑ Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( página 468 en la búsqueda de libros de Google).
- ↑ Erwin Riedel: Química inorgánica moderna . de Gruyter, 2007, ISBN 978-3-11-019060-1 ( página 707 en la búsqueda de libros de Google).
- ↑ Jeremy N. Hill, Robin N. Perutz, A. Denise Rooney: Fluorescencia del renoceno inducida por láser en matrices de baja temperatura: excitación selectiva y emisión . En: J. Phys. Chem. Band 99 , no. 2 , 1995, pág. 531-537 , doi : 10.1021 / j100002a014 .
- ↑ Christian Müller: Estudios fundamentales sobre el crecimiento de ECV de nanotubos de carbono llenos de Fe , disertación, 2007 (PDF; 15,4 MB).
- ^ Didier Astruc: Catálisis y química organometálica . Springer-Verlag, Berlín, Heidelberg 2007, ISBN 978-3-540-46128-9 ( páginas 251-270 en la búsqueda de libros de Google).
- ^ Sally A. Kur, Arnold L. Rheingold, Charles H. Winter: Síntesis, caracterización y halogenación de Decakis (acetoxymercurio) osmocene. Estructura cristalina y molecular del decloroosmoceno . En: Inorg. Chem. Band 34 , no. 1 , 1995, pág. 414-416 , doi : 10.1021 / ic00105a067 .
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Libro de texto de química inorgánica . 101ª edición. Walter de Gruyter, Berlín 1995, ISBN 3-11-012641-9 , p. 1622.
- ↑ a b c d N. El Murr, J. E: Sheats, WE Geiger, JD Holloway: Vías de reducción electroquímica del ion rodocenio. Dimerización y reducción del rodoceno . En: Inorg. Chem. Band 18 , no. 6 , 1979, págs. 1443-1446 , doi : 10.1021 / ic50196a007 .
- ↑ EO Fischer, H. Wawersik: Acerca de los complejos aromáticos de metales. LXXXVIII. Acerca de diciclopentadienilrodio monomérico y dimérico y diciclopentadieniliridio y acerca de un nuevo método para la preparación de complejos aromáticos de metal no cargados . En: J. Organomet. Chem. Band 5 , no. 6 , 1966, págs. 559-567 , doi : 10.1016 / S0022-328X (00) 85160-8 .
- ↑ HJ Keller, H. Wawersik: Investigaciones espectroscópicas sobre compuestos complejos. VI. Espectros EPR de (C 5 H 5 ) 2 Rh y (C 5 H 5 ) 2 Ir . En: J. Organomet. Chem. Band 8 , no. 1 , 1967, pág. 185-188 , doi : 10.1016 / S0022-328X (00) 84718-X .
- ^ B. De Bruin, DGH Hetterscheid, AJJ Koekkoek, H. Grützmacher: La química organometálica de radicales basados en Rh, Ir, Pd y Pt: Especies de Valentina superior . En: Prog. Inorg. Chem. Band 55 , 2007, ISBN 978-0-471-68242-4 , págs. 247-354 , doi : 10.1002 / 9780470144428.ch5 ( [1] ).
- ↑ Helmut Werner, Hans-Jürgen Kraus: Síntesis y dinámica estructural de complejos de bis (ciclopentadienil) fosfano paladio . En: Angewandte Chemie . cinta 91 , no. 12 , 1979, págs. 1013-1014 , doi : 10.1002 / anie.19790911221 .
- ↑ Oleg V. Gusev, Tat'yana A. Peganova, Mikhail G. Peterleitner, Svetlana M. Peregudova, Larisa I. Denisovich, Nikolai A. Ustynyuk: Bis (η 5 -pentametilciclopentadienilo) -y (η 5 -ciclopentadienilo) (η 5- pentametilciclopentadienil) -platino dicaciones: metalocenos de Pt (IV) . En: J. Organomet. Chem. Band 480 , no. 1-2 , 1994, págs. c16-c17 , doi : 10.1016 / 0022-328X (94) 87134-5 .
- ↑ Diego Carrascal, Lucas Fernández-Seivane y Jaime Ferrer: Patrón de densidad de espín oscilante en moléculas de metaloceno y ftalocianina de oro . En: Phy. Rev. B . cinta 80 , 2009, pág. 184415 , doi : 10.1103 / PhysRevB.80.184415 .
- ↑ a b Dirk Bentz: complejos de zinc, cadmio, lantano, cerio y samario con ligandos de alquilciclopentadienilo voluminosos. Disertación 2005, urn : nbn: de: hbz: 386-kluedo-19006
- ↑ Peter HM Budzelaar, Jaap Boersma, Gerrit JM van der Kerk, Anthony L. Spek, Albert JM Duisenberg: La estructura del diciclopentadienylzinc . En: J. Organomet. Chem. Band 281 , no. 2-3 , 1985, págs. 123-130 , doi : 10.1016 / 0022-328X (85) 87100-X .
- ↑ J. Lorberth: Compuestos organometálicos de los elementos iib: diciclopentadienil zinc, cadmio y mercurio . En: J. Organomet. Chem. Band 19 , no. 1 , 1969, pág. 189-190 , doi : 10.1016 / S0022-328X (00) 87767-0 .
- ↑ VV Pavlishchuk, AW Addison: Constantes de conversión de potencial redox medida frente a diferentes electrodos de referencia en acetonitrilo Soluciones a 25 ° C . cinta 298 , no. 1 . Inorg. Chim. Acta , 2000, pág. 97-102 , doi : 10.1016 / S0020-1693 (99) 00407-7 .
- ^ EO Fischer, H. Fischer: Acerca de dicyclopentadienyleuropium y dicyclopentadienylytterbium y triciclopentadienilos de terbio, holmio, tulio y lutecio . En: J. Organomet. Chem. Band 3 , no. 3 , 1965, pág. 181-187 , doi : 10.1016 / S0022-328X (00) 87500-2 .
- ↑ William J. Evans, Laura A. Hughes, Timothy P. Hanusa: Síntesis y caracterización cristalográfica de un complejo de organolantánido de samario monomérico no solvatado (pentametilciclopentadienil), (C 5 Me 5 ) 2 Sm . En: J. Am. Chem. Soc. cinta 106 , no. 15 , 184, págs. 4270-4272 , doi : 10.1021 / ja00327a037 .
- ↑ William J. Evans, Laura A. Hughes, Timothy P. Hanusa: Síntesis y estructura cristalina de rayos X de los complejos de bis (pentametilciclopentadienilo) de samario y europio: (C 5 Me 5 ) 2 Sm y (C 5 Me 5 ) 2 Eu . En: Organomet. cinta 5 , no. 7 , 1986, págs. 1285-1291 , doi : 10.1021 / om00138a001 .
- ↑ Carol J. Burns, Moris S. Eisen: Química de organoactínidos: Síntesis y caracterización . En: La química de los elementos actínidos y transactínidos . cinta 5 , 2008, cap. 25 , pág. 2800-2805 , doi : 10.1007 / 1-4020-3598-5_25 .
- ↑ a b c d Robert E. Dinnebier, Ulrich Behrens, Falk Olbrich: Estructuras de estado sólido de ciclopentadienil-litio, -sodio y -potasio. Determinación por difracción de polvo de alta resolución . En: Organomet. cinta 16 , no. 17 , 1997, pág. 3855-3858 , doi : 10.1021 / om9700122 .
- ↑ un b c Joachim Paap: organilos pi novedosos de metales alcalinos pesados y de magnesio ( memento de la original, del 23 de septiembre, 2015 en el Archivo de Internet ) Info: El archivo de enlace se insertó de forma automática y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso. , Disertación 2004 (pdf, 4.8 MB).
- ↑ a b c Robert E. Dinnebier: Determinación de la estructura cristalina de sustancias moleculares a partir de imágenes de difracción de rayos X en polvos ( Memento del 14 de mayo de 2011 en Internet Archive ), (pdf, 4,1 MB)
- ^ Sjoerd Harder, Marc Heinrich Prosenc: El sándwich metaloceno más simple: el anión litoceno . En: Angew. Chem. Int. Ed. cinta 33 , no. 17 , 1994, pág. 1744-1746 , doi : 10.1002 / anie.199417441 .
- ↑ a b Dietmar Stalke: El anión litoceno y el calcoceno "abierto" Nuevo impulso en la química de los metalocenos alcalinos y alcalinotérreos . En: Angew. Chem. Int. Ed. cinta 33 , no. 21 , 1994, pág. 2168-2171 , doi : 10.1002 / anie.199421681 . , (Pdf, 421 kB) ( Memento de la original, del 5 de marzo, de 2016 en el Archivo de Internet ) Información: El archivo de enlace se inserta de forma automática y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso.
- ^ Zvi Rappoport, Ilan Marek: La química de los compuestos de organolitio . John Wiley & Sons Ltd., 2004, ISBN 0-470-84339-X ( páginas 65-68 en la Búsqueda de libros de Google).
- ↑ EO Fischer, HP Hofmann: Acerca de los complejos aromáticos de metales, XXV. Di-ciclopentadienil-berilio . En: Chem. Ber. cinta 92 , no. 2 , 1959, pág. 482-486 , doi : 10.1002 / cber.19590920233 .
- ↑ EO Fischer, W. Hafner: ciclopentadienil-vanadina-tetracarbonilo. En: Revista de Investigación de la Naturaleza B . 9, 1954, págs. 503-504 (en línea ).
- ↑ G. Wilkenson, FA Cotton, Chem. Ind. (Londres) 1954, págs. 307-308.
- ↑ a b c d e Kai Fichtel: Los compuestos de metaloceno de bario ( Memento de la original, del 23 de septiembre, 2015 en el Archivo de Internet ) Información: El archivo de enlace se insertan automáticamente y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso. , Disertación 2004 (pdf, 5,4 MB).
- ↑ a b c Erwin Riedel: Química inorgánica moderna . de Gruyter, 2007, ISBN 978-3-11-019060-1 ( página 623 en la búsqueda de libros de Google).
- ↑ Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( página 60 en la búsqueda de libros de Google).
- ↑ J. Huheey, E. Keiter, R. Keiter: Química inorgánica . de Gruyter Verlag, 1993, ISBN 3-11-017903-2 ( página 799 en la búsqueda de libros de Google).
- ↑ J. Huheey, E. Keiter, R. Keiter: Química inorgánica . de Gruyter Verlag, 1993, ISBN 3-11-017903-2 ( página 794 en la búsqueda de libros de Google).
- ↑ a b Christoph Elschenbroich: Organometallchemie . BG Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 ( página 70 en la búsqueda de libros de Google).
- ^ RA Andersen, R. Blom, JM Boncella, CJ Burns, HV Volden: Las estructuras moleculares medias térmicas de bis (pentametilciclopentadienil) magnesio (II), -calcio (II) y -iterbio (II) en la fase gaseosa . En: Acta Chem. Scand., Ser. Una . cinta 41 , 1987, págs. 24-35 , doi : 10.3891 / acta.chem.scand.41a-0024 .
- ↑ a b c Aibing Xia, John E. Knox, Mary Jane Heeg, H. Bernhard Schlegel y Charles H. Winter: Síntesis, estructura y propiedades de los aductos de aminas de magnesoceno. Distorsiones estructurales que surgen de NH… C 5 H 5 - Enlaces de hidrógeno y cálculos de orbitales moleculares de los mismos . En: Organomet. cinta 22 , 2003, pág. 4060-4069 . (pdf, 260 kB)
- ^ A b Zvi Rappoport, Ilan Marek: La química de los compuestos de organomagnesio, volumen 2 . John Wiley & Sons Ltd., 2008, ISBN 978-0-470-05719-3 ( páginas 124-129 en Búsqueda de libros de Google).
- ↑ Patente EP1073514 : Método para la producción de partículas recubiertas. Publicado el 7 de febrero de 2001 , inventores: Dieter Vollath, Vinga Szabo, Bernd Seith.
- ↑ Patente US7449404 : Método para mejorar el dopaje con Mg durante MOCVD de nitruro del grupo III. Publicado el 11 de noviembre de 2008 , Inventores: J. Randall Creighton, Goerge T. Wang.
- ↑ Patente EP0325769 : Uso de un combustible líquido sin plomo que contiene ferroceno para operar un motor de encendido por chispa. Publicado el 2 de agosto de 1989 , inventor: Dr. Dieter Höhr, el Dr. August-Wilhelm Preuss, el Dr. Kurt-Peter Schug, Helmut Riegel.
- ↑ a b Michael Aulbach, Frank Küber: Metaloceno: herramientas hechas a medida para la producción de poliolefinas . En: Química en nuestro tiempo . cinta 28 , no. 4 , 1997, pág. 197-208 , doi : 10.1002 / ciuz.19940280410 .
- ^ Didier Astruc: Catálisis y química organometálica . Springer-Verlag, Berlín, Heidelberg 2007, ISBN 978-3-540-46128-9 ( páginas 367-373 en la búsqueda de libros de Google).
- ↑ Hansjörg Sinn, Walter Kaminsky, Hans-Jürgen Vollmer, Rüdiger Woldt: “Living Polymers” en catalizadores Ziegler de productividad extrema . En: Angewandte Chemie . cinta 92 , no. 5 , 1980, págs. 396-402 , doi : 10.1002 / anie.19800920517 .
- ^ A b c Walter Kaminsky : metalocenos . En: Enciclopedia de química industrial de Ullmann . Wiley, 15 de junio de 2006, pág. 685–691 , doi : 10.1002 / 14356007.b16_b36.pub2 (inglés).
- ↑ Walter Kaminsky, Klaus Külper, Hans H. Brintzinger, Ferdinand RWP Wild: Polimerización de propeno y buteno con un zirconoceno quiral y metilaluminoxano como cocatalizador . En: Angewandte Chemie . cinta 97 , no. 6 , 1985, págs. 507-508 , doi : 10.1002 / anie.19850970617 .
- ↑ Alexandra Steffens: complejos de metales alcalinotérreos para la polimerización de monómeros polares , disertación, 2005 (PDF; 3,5 MB).
- ↑ a b P. Köpf-Maier y T. Klapötke : Actividad antitumoral de complejos iónicos de nioboceno y molibdenoceno en estados de alta oxidación . En: Revista de Investigación del Cáncer y Oncología Clínica . cinta 118 , no. 3 , 1992, pág. 216-221 , doi : 10.1007 / BF01410137 .
- ↑ P. Köpf-Maier: Alteraciones histológicas y ultraestructurales de un adenocarcinoma de colon humano xenoinjertado después del tratamiento con dicloruro de titanoceno . En: Revista de Investigación del Cáncer y Oncología Clínica . cinta 114 , no. 4 , 1988, págs. 250-258 , doi : 10.1007 / BF00405830 .
- ↑ P. Köpf-Maier: Inhibición tumoral por complejos de titanoceno: influencia sobre los adenocarcinomas humanos xenoinjertados del tracto gastrointestinal . En: Quimioterapia y farmacología del cáncer . cinta 23 , no. 4 , 1989, págs. 225-230 , doi : 10.1007 / BF00451646 .
- ↑ P. Manohari Abeysinghe y Margaret M. Harding: Complejos metálicos antitumorales de bis (ciclopentadienilo): dicloruro de titanoceno y molibdoceno y derivados . En: Transacciones de Dalton . cinta 32 , 2007, pág. 3474-3482 , doi : 10.1039 / B707440A .
- ↑ Alexander Gmeiner: Contribuciones a la química de los complejos de metales de transición con alquenil carbenos, fosforiluros y compuestos hidroxi bioactivos como ligandos , disertación 2010 (pdf, 7,1 MB).
- ↑ L. Wagner: Compuestos organometálicos sintéticos como inductores de apoptosis. Disertación, Charité de la Facultad de Medicina - Universitätsmedizin Berlin, 2012, p. 6.












![{\ mathrm {RuCl_ {3} (H_ {2} O) _ {x} +3 \ C_ {5} H_ {6} {\ xrightarrow [{-ZnCl_ {2}}] {+ Zn, \ Etanol}} \ Ru (C_ {5} H_ {5}) _ {2} + C_ {5} H_ {8} \}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a344cc3297d6b52b26a913fb0dd80c9dfc99fab7)



![{\ mathrm {Mg (C_ {2} H_ {5}) Br \ {\ xrightarrow [{-C_ {2} H_ {6}}] {+ C_ {5} H_ {6}, \ Et_ {2} O }} \ Mg (C_ {5} H_ {5}) Br {\ xrightarrow {x2, \ 220 ^ {\ circ} C, \ 10 ^ {{- 4}} mbar}} \ Mg (C_ {5} H_ {5}) _ {2} + MgBr_ {2} \ \ \ Et_ {2} O = éter dietílico}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ba149b2568c2b81381305bffe338a5e470151fb)



![{\ mathrm {M + \ 2 \ C_ {5} H_ {6} \ {\ xrightarrow [{2do vacío sub. \ 260 \, ^ {{\ circ}} {\ mathrm {C}} \ - \ 360 \ , ^ {{\ circ}} {\ mathrm {C}}}] {1.THF / DMF, -H_ {2}}} \ M (C_ {5} H_ {5}) _ {2} \ \ \ M = Ca, Sr \}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bfee95ccb3945baf0d03d23d73063d1114bce206)