Quiste de riñón
| Clasificación según ICD-10 | |
|---|---|
| Q61.1 | Riñón poliquístico, tipo infantil autosómico recesivo |
| Q61.2 | Riñón poliquístico, tipo adulto autosómico dominante |
| Q61.3 | Riñón poliquístico, no especificado |
| CIE-10 en línea (OMS versión 2019) | |

La enfermedad renal poliquística , también conocido como riñón poliquístico señalado ( Inglés poliquística renal enfermedad , PCD son un grupo de la mayoría graves,) hereditarios relacionados con la PI enfermedades del riñón . Debido a la formación de un gran número (en griego antiguo πολύς polys 'much') de cámaras o vesículas llenas de líquido, los llamados quistes , los riñones están considerablemente restringidos en su función de filtrado . Un quiste renal , por otro lado, es un quiste único que generalmente se menciona como un hallazgo casual inofensivo en el curso de un examen .
Los quistes renales genéticamente determinados son la enfermedad hereditaria potencialmente mortal más común en los seres humanos y una de las principales causas de insuficiencia renal crónica . La cura solo es posible con un trasplante de riñón .
Síntomas
Los primeros síntomas que pueden indicar riñones quísticos son presión arterial alta , orina con sangre ( hematuria ), infecciones repetidas del tracto urinario , aumento del tamaño del abdomen y dolor en el abdomen. Siempre que los riñones puedan compensar cualquier deterioro funcional, a menudo no hay síntomas. Aproximadamente un tercio de los pacientes permanecen asintomáticos , incluso hasta el punto de insuficiencia renal terminal (ESRF). Esto hace que un diagnóstico precoz sea mucho más difícil. La creciente destrucción del tejido renal conduce a más y más molestias en varios órganos debido a los productos de desecho retenidos y al agua. Estos incluyen disminución del rendimiento y malestar, coloración amarillenta y picazón de la piel debido a las toxinas almacenadas en la orina, trastornos del sueño y de concentración, dolores de cabeza, calambres en las pantorrillas, náuseas, vómitos, diarrea y trastornos del gusto. También se producen hipertensión arterial, arritmias cardíacas o inflamación y problemas respiratorios. Además, hay anemia (debido a la reducción de la eritropoyetina producida por el riñón, que se utiliza para la formación de sangre), trastornos de la coagulación, mayor susceptibilidad a infecciones, hemorragia cerebral y ablandamiento de los huesos (ya que el riñón también está involucrado en metabolismo de la vitamina D).
Los pacientes con poliquistosis renal a menudo se quejan de dolor en el lado flanco de su espalda o el abdomen . El dolor puede ser temporal o permanente, sordo e insoportable. El dolor probablemente se deba al extenso crecimiento del quiste. Además, los órganos circundantes son desplazados por el estiramiento extremo de la cápsula renal (Capsula fibrosa renalis) .
El dolor puede aliviarse brevemente perforando los quistes, por ejemplo , de forma percutánea , es decir, a través de la piel, o de forma mínimamente invasiva mediante decorticación laparoscópica de los quistes. Debido a la formación de nuevos quistes, estas medidas no son sostenibles, por lo que hay que repetir las intervenciones correspondientes. Además, el tratamiento no cambia el curso de la enfermedad.
En alrededor del 30 al 50% de los pacientes, el diagnóstico inicial de "riñones poliquísticos" se realiza a partir de orina con sangre ( hematuria ). La causa del sangrado suele ser grietas en los quistes. El sangrado en sí es en gran parte inofensivo y se detiene por sí solo. Debido a la función renal alterada, los pacientes con riñones quísticos excretan cantidades mayores de proteínas endógenas en la orina . Si el cuerpo excreta de 30 a 300 miligramos de albúmina por día , se denomina microalbuminuria . Si se excretan cantidades aún mayores de albúmina, esto se denomina macroalbuminuria . Si se pueden detectar proteínas más grandes que la albúmina en la orina, hay proteinuria . Este último se puede detectar fácilmente con tiras reactivas que se mantienen en la orina. La microalbuminuria es mucho más difícil de detectar. Las proteínas y la microalbuminuria son una indicación de insuficiencia renal. Los riñones poliquísticos son solo una de las posibles afecciones que pueden provocar esta disfunción.
La hipertensión arterial ("hipertensión") se localiza frente a los pacientes con poliquistosis renal en un 50 a 75%. La presión arterial de los afectados a menudo ya aumenta significativamente antes de una disminución de la función renal ( tasa de filtración glomerular , TFG).
Diagnóstico

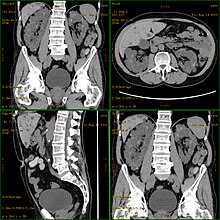
El diagnóstico generalmente se realiza mediante ecografía ("ultrasonido") o mediante otros métodos de obtención de imágenes , como la tomografía por resonancia magnética . Con la ecografía, los quistes de hasta 5 mm se pueden diagnosticar con dispositivos modernos. La tasa de detección precoz en pacientes de 20 años ronda el 90%. Aunque la tomografía computarizada ofrece una resolución más alta con mejor calidad de imagen, no se usa para exámenes de detección de pacientes , principalmente debido a la exposición a la radiación , sino solo para preguntas de diagnóstico especiales.
La biopsia , en la que se extrae una pequeña cantidad de tejido renal y hepático, se usa en la infancia para diferenciar entre ARPKD y ADPKD ( de inicio temprano ) . Esto significa que los cambios morfológicos en la membrana basal se pueden detectar en una etapa muy temprana. La ARPKD se diagnostica determinando la fibrosis hepática congénita .
Según Osathanondh y Potter , los riñones del quiste se dividen patológica y anatómicamente en los siguientes tipos:
| Tipo | Infestación | Tamaño del riñón | Tamaño del quiste | Glomérulos | Quistes de las vías biliares | Tiempo de supervivencia |
|---|---|---|---|---|---|---|
| I. | ambos lados | agrandado a muy agrandado | uniformemente ancho (12 mm) | normal | disponible | Periodo neonatal |
| II | de doble cara, unilateral o parcialmente | agrandado o reducido | diferente tamaño | disminuido y anormal | indisponible | Edad adulta |
| III | mayormente bilateral | engrandecido | diferentes tamaños, a veces muy lejos | quistes glomerulares | ocasionalmente, pero solo en áreas circunscritas | Edad adulta |
| IV | ambos lados | disminuido | pequeño, ubicado subcapsularmente | Glomérulos disminuidos, quistes glomulares | indisponible | Edad adulta |
En la práctica, sin embargo, los tipos definidos de esta manera a menudo no permiten una clasificación clara . Además de la descripción patoanatómica de los riñones y el hígado, la historia familiar ( anamnesis ) juega un papel importante. Para los casos hereditarios de los quistes renales, los términos de base genética autosómica - dominante y autosómica recesiva se utilizan normalmente.
Al identificar genes potencialmente afectados, es posible un diagnóstico genético molecular demostrativo no invasivo . En muchos casos, este procedimiento puede reemplazar el diagnóstico de biopsia invasiva y permitir la clasificación etiológica . Esta clasificación a su vez abre caminos para opciones terapéuticas diferenciales para el tratamiento de la enfermedad. La sensibilidad para un resultado realmente positivo ronda el 95%. La correlación entre genotipo y fenotipo solo es posible hasta cierto punto. El análisis de mutaciones es difícil con el gen PKD1 debido a su tamaño (46 exones codificantes y 14,2 kb de transcripción ). Además, los primeros 33 exones de PKD1 en tres copias homólogas del cromosoma 16 afectado en el locus del gen p13.1 (HG-A ≈21 kb, HG-B ≈17 kb y HG-C ≈8.5 kb; HG = gen homólogo ) están presentes. Esto dificulta considerablemente la multiplicación específica mediante la reacción en cadena de la polimerasa (PCR).
A partir del diagnóstico genético molecular surge un problema particular. El diagnóstico precoz de la predisposición genética del paciente permite , por un lado, medidas profilácticas y terapia de apoyo precoz. Por otro lado, los familiares y los pacientes pueden enfrentarse a la probabilidad de que estalle una enfermedad potencialmente mortal en varias décadas desde la niñez. Por lo tanto, los riesgos y beneficios deben sopesarse cuidadosamente antes de un diagnóstico.
En pacientes con predisposición familiar , el diagnóstico se puede realizar mediante ecografía a partir de los 20 años si se pueden detectar al menos dos quistes renales por riñón. La ausencia de quistes, en cambio, descarta la enfermedad en los mayores de 30 años.
Patogénesis
El origen y desarrollo de los riñones quísticos, la patogenia , se basa en una degeneración quística de los llamados túbulos (túbulos renales, también: túbulos urinarios) en los riñones. En el caso de la PKD hereditaria autosómica dominante, esto conduce a un aumento de tamaño de los riñones a lo largo de las décadas. Esto puede provocar un deterioro funcional o incluso la pérdida completa de la función de filtrado del riñón. Ambos riñones se ven igualmente afectados. Varios cientos de quistes, que son voluminosos en su apariencia, pueden desarrollarse por órgano. Como resultado, la masa y el volumen de los riñones pueden aumentar significativamente. Mientras que un riñón sano tiene una masa media de 160 g , los riñones poliquísticos pueden alcanzar hasta 8 kg con un volumen de hasta 40 × 25 × 20 cm³ (= 20 litros) (riñón sano: 12 × 6 × 3 cm³ = 0,216 litros ). A pesar del requerimiento de espacio significativamente mayor del órgano, los trastornos funcionales de los órganos vecinos solo ocurren relativamente raramente.
Los quistes se encuentran tanto en la médula renal (médula renis) como en la corteza renal (corteza renal) . En principio, cualquier área de una nefrona puede desarrollar un quiste. Sin embargo, los glomérulos y el asa de Henle se ven afectados principalmente . Los quistes están llenos de lo que se conoce como orina tubular . El diámetro de un solo quiste puede variar ampliamente desde unos pocos milímetros hasta más de 100 mm. Los quistes grandes pueden contener varios cientos de mililitros de orina tubular. El interior del quiste consiste en una sola capa de epitelio escamoso o isoprismatic de una sola capa (cúbico) epitelio . A medida que avanza la enfermedad, tanto el número como el tamaño de los quistes presentes pueden aumentar.
etiología
Los cambios poliquísticos en los riñones son una afección que se presenta en varias enfermedades. Pueden surgir esporádicamente como una desviación del desarrollo normal de los riñones o pueden adquirirse en la vida adulta ( riñones quísticos adquiridos) . La causa mucho más común ( etiología ) de esta enfermedad son los defectos hereditarios en ciertos genes ( riñones quísticos hereditarios ) . Con mucho, la mayor parte se toma por la enfermedad renal poliquística autosómica dominante ( Inglés enfermedad poliquística autosómica dominante del riñón , PQRAD ). Esta enfermedad es la causa hereditaria más común de insuficiencia renal crónica : alrededor del 7% de todos los pacientes en diálisis la padecen.
Además, varias otras enfermedades hereditarias, mucho más raras, causan riñones quísticos. También se pueden desarrollar riñones quísticos adquiridos, especialmente en pacientes en diálisis. Dado que la gran mayoría de los riñones de quiste son causados por la PQRAD, el término "riñón de quiste" se utiliza a menudo como sinónimo de PQRAD.
Riñones quísticos hereditarios
La mayoría de las enfermedades renales poliquísticas son hereditarias ( hereditarias ). Una gran cantidad de genes diferentes pueden verse afectados y, por lo tanto, desencadenar la enfermedad. Los síndromes enumerados a continuación representan una selección de las enfermedades renales poliquísticas hereditarias más importantes, algunas de las cuales se incluyen en el llamado complejo NPH-MCKD .
| gene | Locus del gen cromosómico |
proteína | enfermedad | Incidencia | Edad ∗) |
|---|---|---|---|---|---|
| Dominante autosómico | |||||
| PKD1 | 16 p13.3 | Policistina-1 | ADPKD | 1: 500-1000 | aprox.50 |
| PKD2 | 4 q21-q23 | Policistina-2 | ADPKD | 1: 3500-7000 | aprox.70 |
| BVS | 3 p26-p25 | VHL30 | Von-Hippel-Lindau | 1: 35.000 | 20-30 |
| TSC1 | 9 q34 | Hamartin | Esclerosis tuberosa | 1: 10,000 (ambos juntos) | 30-40 |
| TSC2 | 16 p13.3 | Tuberina | Esclerosis tuberosa | ||
| ? | 1 q21 | Enfermedad renal quística medular tipo 1 | 1 a 9: 1.000.000 (tipo 1 + 2) | 62 | |
| UMOD | 16 p12.3 | Uromodulina | Enfermedad renal quística medular tipo 2 | 32 | |
| Autosómica recesiva | |||||
| PKHD1 | 6 p21.2-p12 | Fibrocistina | ARPKD | 1: 20.000 | <20 |
| NPHP1 | 2 q13 | Nefrocistina-1 | Nefronoptisis (juvenil) | aprox.1: 100.000 (todos NPHP) | 13 |
| NPHP2 | 9 q22-q31 | Inverso | Nefronoptisis (infantil) | <1 | |
| NPHP3 | 3 q22.1 | Nefrocistina-3 | Nefronoptisis (adolescente) | 19 | |
| NPHP4 | 1 p36.22 | Nefroretinina | Nefronoptisis | 21 | |
| NPHP5 | Nefrocistina 5 | Nefronoptisis | 13 | ||
| NPHP6 | Nefrocistina 6 | Nefronoptisis | |||
| GLIS2 | 16 p13.3 | Proteína 2 similar a GLI | Nefronoptisis | ||
| BBS1 | 11 q13.1 | Proteína BBS1 | Síndrome de Bardet-Biedl | 1: 140.000 (todas BBS) | |
| BBS2 | 16 q21 | Proteína BBS2 | Síndrome de Bardet-Biedl | ||
| ARL6 | 3 p13-p12 |
Proteína BBS3 Proteína similar al factor de ribosilación de ADP 6 |
Síndrome de Bardet-Biedl | ||
| BBS4 | 15 q22.3-q23 | Proteína BBS4 | Síndrome de Bardet-Biedl | ||
| BBS5 | 2 q31.1 | Proteína BBS5 | Síndrome de Bardet-Biedl | ||
| MKKS | 20 p12 | Proteína BBS6 | Síndrome de McKusick-Kaufman | ||
| BBS7 | 4 q27 | Proteína BBS7 | Síndrome de Bardet-Biedl | ||
| TTC8 | 14 q31.3 | Proteína BBS8 | Dominio de repetición tetratricopeptide 8 | ||
| BBS9 | 7 p14 | PTHB1 | Síndrome de Bardet-Biedl | ||
| BBS10 | 12 q21.2 | Proteína BBS10 | Síndrome de Bardet-Biedl | ||
| TRIM32 | 9 q33.1 | Proteína de dedo de zinc HT2A | Motivo tripartito que contiene 32 | ||
| BBS12 | 4 q27 | Proteína BBS12 | Síndrome de Bardet-Biedl | ||
| Dominante ligado al cromosoma X | |||||
| CXORF5 | X p22.3-p22.2 | OFD1 | Síndrome oro-facio-digital tipo 1 | 1: 250.000 | |
| Herencia desconocida | |||||
| ? | ? | Riñón quiste medular | 1: 5000 | 40-50 | |
| ? | ? | Displasia renal multiquística | <10 y 50-60 |
Enfermedad renal poliquística autosómica dominante
La enfermedad renal poliquística autosómica dominante (PQRAD), también conocida como degeneración renal quística de Potter tipo III , es la enfermedad hereditaria potencialmente mortal más común en los seres humanos. Hay aproximadamente 5 millones de personas afectadas por la PQRAD en todo el mundo. La incidencia es de 1: 500 a 1: 1000. Por ejemplo, en los Estados Unidos, es dos veces más común que la esclerosis múltiple y diez veces más común que la anemia de células falciformes . Hombres y mujeres son igualmente afectados. La raza y el origen también son irrelevantes. Los síntomas generalmente se observan solo en la edad adulta. La herencia de la PQRAD es autosómica dominante ( monogénica ) con penetrancia completa . Debido a la herencia autosómica dominante, la mitad de los niños heredan el gen mutado de sus padres en una media estadística y desarrollarán PQRAD ellos mismos. Aproximadamente el 50% de todos los portadores de mutaciones sufren insuficiencia renal progresiva. A una edad promedio de 58 años, la terapia de reemplazo renal está indicada en la mitad de los pacientes con PQRAD .
Como enfermedad sistémica en la PQRAD, otros órganos, en la mayoría de los casos el hígado , a menudo se ven afectados por la formación de quistes. Según el autor, hasta el 75% de los afectados por PQRAD tienen quistes hepáticos.
genética
Hasta ahora, se han identificado mutaciones en dos genes diferentes como la causa de la enfermedad en pacientes con PQRAD: los genes PKD1 y PKD2 . En los seres humanos, PKD1 se encuentra en el locus del gen del cromosoma 16 16p13.3-p13.12. Que codifica para la proteína policistina-1 . En pacientes con mutaciones significativas en PKD1, la insuficiencia renal alcanza su etapa final a una edad promedio de 50 años, lo que significa que está indicada la terapia de reemplazo renal. Los pacientes con mutaciones en PKD2, que se encuentra en el locus q21-q23 del gen del cromosoma 4 y codifica la poliquistina-2, alcanzan esta etapa considerablemente más tarde, con una edad promedio de 70 años ( aparición tardía ) . Aproximadamente el 85% de los pacientes con PQRAD son portadores de una o más mutaciones en PKD1. El 15% restante se debe a mutaciones en PKD2.
A nivel celular, la PQRAD es un mecanismo recesivo. La primera condición de la enfermedad es una mutación de la línea germinal en uno de los alelos PKD1 o PKD2 . En segundo lugar , debe producirse una mutación somática , el llamado segundo golpe, para que se inicie la formación del quiste. Esta pérdida de heterocigosidad ( pérdida de heterocigosidad , LOH) que se encuentra en la PQRAD obviamente lleva una eternidad. La mutación somática inicial puede estar en el otro gen. En este caso, llamado transheterocigosidad , la mutación de la línea germinal es PKD1 y la mutación somática es PKD2, o viceversa. En modelos animales, se encontró que las mutaciones de la línea germinal que afectan a ambos alelos de un gen PKD son perinatalmente fatales. Con el segundo golpe , la célula afectada pierde su capacidad de inhibir la proliferación y se convierte así en el punto de partida para la formación de un nuevo quiste. Un indicador importante de la exactitud de la teoría del segundo acierto son los experimentos con ratones knockout en los que PKD1 o PKD2 se desactivaron ( deleción de genes ). Solo los animales homocigotos se enferman , mientras que los heterocigotos se desarrollan casi normalmente. La teoría del segundo golpe también explica por qué solo alrededor del 1% de todas las nefronas en la PQRAD forman quistes, a pesar de que todas las células portan la mutación heredada.
En 1995, se sospechaba que un tercer gen, llamado PKD3, era otra posible causa de la PQRAD. Posteriormente se observaron mutaciones que no fueron causadas por PKD1 o PKD2 en otras cuatro familias con riñones quísticos de diferentes países. Ahora se cuestiona la existencia de este gen.
| gene | Loci | Exones | Tipo de mutación | Frecuencia (%) |
| PKD1 | 16p13.3 | 46 (14,1 KB) | Disparates | 33 |
| Cambio de cuadro | 28 | |||
| En el marco de | Sexto | |||
| Empalme | 14 | |||
| Sin sentido | 19 | |||
| PKD2 | 4q21-q23 | 15 (5 kb) | Disparates | 37 |
| Cambio de cuadro | 39 | |||
| Empalme | 17 | |||
| Sin sentido | Sexto | |||
| Supresión | 1 |
Causas moleculares y formación de quistes.
Las proteínas codificadas por los genes afectados policistina-1 y policistina-2 así como la fibrocistina codificada por el gen PKHD1 están localizadas en la base del cilio primario de las células del túbulo renal (células del túbulo renal) . El cilio primario es una extensión de células delgadas como un cabello, de las cuales cada célula solo desarrolla una. Según el conocimiento actual, un mal funcionamiento del cilio primario juega un papel decisivo en la formación de quistes en todas las enfermedades que conducen a los riñones de quiste. Los cilios primarios de las células tubulares sobresalen hacia la luz tubular y probablemente se utilizan allí para percibir el flujo de líquido. Además, el cilio primario participa en la alineación espacial del huso mitótico durante la división celular . Las dos policistinas forman un canal iónico regulador del calcio que es permeable a los iones calcio. El complejo de policistina juega un papel importante en el cilio primario con varias vías de señal y funciones mecano-sensoriales. La función fisiológica de este orgánulo celular todavía no se comprende en gran medida.
El origen de los quistes puede tener su punto de partida en cualquier sección de una nefrona, desde el glomérulo hasta los conductos colectores (tubulus renalis colligens) . Cuando los quistes alcanzan un diámetro de más de 0,2 mm, ya no tienen conexión con los túbulos renales (túbulos) .
Para que se formen los quistes, la cantidad de células dentro de la pared del quiste debe aumentar. Esto sucede por una proliferación excesiva de las células epiteliales de los riñones. La proteína mTor (objetivo de la rapamicina en mamíferos) está regulada positivamente . El líquido también debe acumularse en la luz del quiste debido al aumento de la secreción y / o la disminución del drenaje. Esta secreción de líquido transepitelial depende de la secreción secundaria del ion cloruro activo. La secreción de iones de cloruro está regulada por el CFTR (regulador de la conductancia transmembrana de la fibrosis quística) o por un canal de cloruro dependiente de calcio. Ambos están ubicados en la membrana celular apical .
Evolución y pronóstico
El curso de la PQRAD es lentamente progresivo (progresivo). Incluso antes del inicio de la insuficiencia renal, se puede detectar una alteración en la concentración de orina (reabsorción de agua) en los pacientes afectados. En las primeras etapas de la enfermedad, la función renal no se ve afectada por la formación de quistes. El rendimiento solo disminuye a partir de un tamaño de riñón de 1000 cm³. Si el volumen del riñón es superior a 1500 cm³, la tasa de filtración glomerular se reduce anualmente entre 4 y 5 ml · min −1 aproximadamente . En promedio, el volumen de los riñones aumenta en más del 5% por año en pacientes con un volumen de riñón de más de 750 cm³. Los primeros síntomas de la enfermedad suelen notarse entre los 30 y los 40 años. En general, sin embargo, existe una amplia gama de variaciones, a menudo dentro de una familia.
En casi todos los casos, la enfermedad conduce a insuficiencia renal terminal (insuficiencia renal final). Las mujeres llegan a esta etapa un promedio de seis años más tarde que los hombres.
Entonces, solo se garantiza una mayor supervivencia a través de la terapia de reemplazo renal, es decir, diálisis o trasplante de riñón. Todavía no se comprende completamente por qué los riñones poliquísticos finalmente conducen a una enfermedad renal en etapa terminal. El mecanismo no puede explicarse únicamente por la atrofia por presión del parénquima. Las intervenciones quirúrgicas como los pinchazos no retrasan el curso de la enfermedad. De los exámenes histológicos se puede concluir que la hipertensión es un factor importante para la progresión (progresión) de la insuficiencia renal.
Además de la genética, el entorno y el estilo de vida del paciente también influyen en el curso de la PQRAD. En las mujeres, por ejemplo, se encontró que los partos múltiples y otros factores estrogénicos empeoran significativamente el curso de la enfermedad. El crecimiento acelerado de los quistes en comparación con las mujeres y el alcance más temprano de la insuficiencia renal terminal en los hombres también se atribuyen a influencias hormonales. Además, el tabaquismo influye, especialmente entre los hombres, en la progresión negativa de la PQRAD. Una posible explicación son los conocidos efectos negativos del tabaquismo en los vasos sanguíneos .
Esperanza de vida
En un estudio, se compararon 333 pacientes de 31 familias con PKD1 y 291 pacientes con PKD2 de 31 familias con un grupo de control geográficamente idéntico de 398 personas. Los pacientes con PKD1 alcanzaron una edad media de 53,0 años (± 1,8 años; 95% de probabilidad). Por otro lado, los pacientes con PKD2 llegaron a un promedio de 69,1 años (± 2,2 años; 95%), mientras que las personas del grupo control tenían 78,0 años (± 4,2 años; 95%) (ver gráfico adyacente).
Causas de muerte
La causa de muerte de 129 pacientes con PQRAD se analizó en un estudio retrospectivo. Después de eso, el 36% murió de enfermedad cardíaca y el 24% de infecciones . En el 94% de las infecciones, estaba presente la sepsis (envenenamiento de la sangre). Las autopsias revelaron hipertrofia cardíaca en el 89% de todos los pacientes y enfermedad de las arterias coronarias en el 81% . Un evento neurológico provocó la muerte en el 12% de los pacientes y la rotura de un aneurisma cerebral en el 6%. La hemorragia cerebral por hipertensión fue la causa de muerte en el 5% y un ictus isquémico en el 1% de los pacientes. Ningún paciente murió de cáncer de riñón .
Enfermedad renal poliquística autosómica recesiva
La enfermedad renal poliquística autosómica recesiva ( ARPKD ), también conocida como riñón esponja o riñón Potter I , se manifiesta en la niñez. La prevalencia de esta enfermedad en recién nacidos está en el rango de 1: 6.000 a 1: 40.000, con un promedio de 1: 20.000. Por tanto, la enfermedad es relativamente rara. La penetrancia está completa. Aproximadamente una de cada setenta personas es portadora de la mutación (ver diagrama de herencia autosómica recesiva). Las mutaciones en el gen PKHD1 , que en los seres humanos se encuentra en el cromosoma 6 , locus del gen p21.1-p12, pueden conducir a la formación de riñones quísticos. La proteína fibrocystin codificada por PKHD1 se encuentra junto con policistina-2 en el cuerpo basal de la cilios primarios . En el apical dominio de las células epiteliales polarizadas, que está aparentemente implicado en la formación de los túbulos y / o el mantenimiento de la arquitectura de los lumen de la tubo colector . En consecuencia, los conductos colectores se ven afectados esencialmente por la formación de quistes en ARPKD. La enfermedad renal poliquística autosómica recesiva se asocia con fibrosis hepática congénita.
ARPKD se manifiesta en pacientes a una edad muy temprana ( inicio temprano ) . El rango de edad es de 0 a 20 años. La esperanza de vida media de los niños afectados es de seis años. Se hace una distinción entre la forma perinatal (semana 28 de embarazo hasta siete días después del nacimiento), neonatal (recién nacido), infantil (infantil) y juvenil (adolescente). Cuanto menor sea la edad de inicio, peor será el pronóstico .
Complejo NPH-MCKD
El complejo NPH-MCKD (nefronoptisis-enfermedad renal quística medular) es un grupo de enfermedades genéticas del riñón que conducen a un quiste renal. En el caso de la nefronoptisis, la herencia es autosómica recesiva, mientras que es autosómica dominante en ambas formas de enfermedad renal quística medular. El cuadro clínico común de las enfermedades es la formación de riñones quísticos en el borde corticomedular (borde corticomedular). Dependiendo del gen afectado, todas las enfermedades del complejo NPH-MCKD conducen a insuficiencia renal terminal en ciertos rangos de edad.
Síndrome de Bardet-Biedl
El síndrome de Bardet-Biedl (BBS) es una enfermedad hereditaria oligogenética muy rara con una herencia autosómica dominante. La causa de la enfermedad son mutaciones en los genes BBS 1 a 12. Además de la formación de riñones poliquísticos, hay degeneración de la retina , la infancia obesidad , discapacidad intelectual , malformaciones de la aparato urinaria y sexual y polidactilia (varios dedos) .
Esclerosis tuberosa
Los quistes renales individuales son frecuentes en la esclerosis tuberosa hereditaria autosómica dominante. La enfermedad renal poliquística también es menos común. La razón de esto suelen ser deleciones más grandes que afectan tanto al gen TSC2, que se ve afectado en la esclerosis tuberosa, como al gen PKD1; ambos genes se encuentran muy próximos en el cromosoma 16 .
Síndrome oro-facio-digital tipo 1 (OFD 1)
El síndrome oro-facio-digital tipo 1, también conocido como síndrome de Papillon-Leage-Psaume, es una enfermedad hereditaria dominante ligada al cromosoma X muy rara . La prevalencia en recién nacidos es de alrededor de 1: 250.000. La enfermedad tiene varios síntomas diferentes, particularmente en la cara y la boca, y en muchos pacientes se observa una tendencia a tener riñones poliquísticos. Estos últimos suelen diagnosticarse muy tarde cuando la insuficiencia renal está muy avanzada.
La enfermedad es prenatalmente fatal para los hombres .
Con el síndrome orofazio - digital tipo 2 , OFD2 o síndrome de Mohr , no se observan cambios en los riñones.
Riñones quísticos adquiridos
Una forma especial de Endstadiumniere, como transformada secundaria poliquística o como riñón quístico adquirido (engl. Enfermedad renal quística adquirida , ERCA ) se refiere al 50% de todos los pacientes que se desarrollan a los 40 años después de una diálisis a largo plazo. Ella es una complicación muy grave en ESRD ( enfermedad renal en etapa terminal inglesa , ESRD ). En el caso de los receptores de trasplantes , tanto sus propios riñones como el trasplante pueden verse afectados. La causa del desarrollo del quiste renal adquirido relacionado con la diálisis suele ser una diálisis a largo plazo por nefropatía por analgésicos . Los quistes en los riñones son muy comunes en pacientes con enfermedad renal en etapa terminal. La frecuencia y el tamaño de los quistes aumentan con la duración de la diálisis. Ambos sexos se ven igualmente afectados por la enfermedad, independientemente de la edad del paciente. La probabilidad de que el cáncer de riñón se desarrolle como una complicación adicional aumenta significativamente, especialmente en pacientes masculinos.
terapia
Actualmente, solo hay un medicamento aprobado para el tratamiento de la poliquistosis renal ( tolvaptán , ver más abajo). Aproximadamente el 50% de todos los pacientes con PQRAD, que constituyen la mayoría de los pacientes con enfermedad renal poliquística, requerirán terapia de reemplazo renal durante su vida. La curación solo es posible mediante un trasplante de riñón .
Medidas adyuvantes
El ajuste de la presión arterial, generalmente con la ayuda de inhibidores de la ECA , es de particular importancia como medida adyuvante en los riñones poliquísticos. Además, existen una serie de recomendaciones para pacientes con riñones quísticos, que tampoco permiten una cura, pero hacen que la progresión de la enfermedad sea más favorable para el paciente.
Dado que se sospecha que la cafeína acelera el crecimiento del quiste, los pacientes deben evitar las bebidas que contengan cafeína si es posible. Una dieta baja en sal ayuda a reducir la presión arterial, que se asocia con una excreción deficiente de iones de sodio. Los antiinflamatorios no esteroideos , los analgésicos mixtos , ciertos antibióticos y otros medicamentos que son tóxicos para los riñones deben evitarse en la medida de lo posible. Las infecciones de quistes, por otro lado, se tratan lo antes posible con antibióticos que pueden penetrar el quiste o la bilis .
Terapia de reemplazo renal
Solo la terapia de reemplazo renal, es decir, diálisis o trasplante de riñón, asegura la supervivencia del paciente en insuficiencia renal terminal. En la mayoría de los casos, la diálisis se lleva a cabo en forma de hemodiálisis , ya que los riñones de gran tamaño, y a menudo el hígado, hacen que la cavidad abdominal esté muy apretada y, por lo tanto, no es posible la diálisis peritoneal . Si es posible, el trasplante de riñón es preferible a la diálisis. Permite la restauración del rendimiento físico, la calidad de vida y la integración social del paciente. También mejora significativamente la esperanza de vida en comparación con la diálisis. Los largos tiempos de espera para los riñones de donantes son problemáticos debido al bajo número de riñones de donantes disponibles.
Los riñones poliquísticos, a diferencia de la práctica anterior, solo se eliminan antes del trasplante en casos excepcionales, por ejemplo, cuando el volumen del riñón ha alcanzado un tamaño crítico.
Enfoques terapéuticos futuros
El tratamiento de pacientes con riñones quísticos incurre en costos anuales de más de mil millones de dólares estadounidenses solo en los EE. UU. Esta suma resulta fundamentalmente de los costes de la terapia de sustitución renal necesaria en la insuficiencia renal terminal.
La multiplicación y el aumento de tamaño de los quistes llenos de líquido de paredes delgadas dependen de dos procesos: la proliferación de células del epitelio del quiste y la secreción de líquido en los quistes. Ambos procesos dependen de cAMP . El cAMP estimula la vía de la cinasa Ras / MAP y, por tanto, conduce a un crecimiento celular anormal. Además, cAMP activa el CFTR - canal de cloruro , promoviendo así la secreción de fluido en quistes. Los enfoques terapéuticos que se están probando actualmente abordan ambos procesos dependientes de AMPc para ralentizar la formación y el crecimiento del quiste.
También se está investigando la posible implicación de la proteína C-Met y, asociada a ella, una terapia con inhibidores de C-Met , que han mostrado resultados prometedores en experimentos con animales con ratones .
Procedimientos de imagen e investigación de nuevos enfoques terapéuticos
La edad promedio en el momento del diagnóstico de la PQRAD es actualmente de 27 años. Si se produce insuficiencia renal, hay una rápida disminución de la TFG de ~ 5,9 ml / min por año. Hasta ahora, ningún estudio aleatorizado en esta última etapa de la enfermedad ha podido demostrar el efecto beneficioso de un tratamiento. Debido a la fase presintomática prolongada y al inicio tardío de la insuficiencia renal , los criterios de valoración principales que suelen examinarse en los estudios sobre la enfermedad renal crónica, como el tiempo hasta el tratamiento de diálisis, la duplicación de la creatinina sérica o la muerte, tienen un uso limitado en los estudios sobre poliquistosis. nefropatía. Fue por esta razón que se creó el Consorcio para Estudios de Imágenes Radiológicas de la Enfermedad Renal Poliquística. (CRISP), cuya tarea es examinar métodos de imagen que permitan hacer declaraciones sobre el curso de la enfermedad en las primeras etapas. Un resultado importante de las investigaciones de CRISP utilizando imágenes de resonancia magnética es que los quistes en pacientes con ACPKD crecen de forma continua y cuantificable y que el crecimiento del quiste se correlaciona con la disminución de la función renal. Es decir, un mayor aumento en el tamaño del quiste se asocia con una disminución más rápida de la función renal.
HALT-Polycystic Kidney Disease (HALT-PKD) es un estudio prospectivo que actualmente investiga los efectos de un bloqueo del sistema renina-angiotensina-aldosterona y / o un control estricto de la presión arterial en las primeras etapas de la enfermedad sobre el crecimiento del quiste o en las etapas posteriores de la enfermedad afectan la duplicación de la creatinina sérica, el inicio de la diálisis y la muerte.
Inhibición de la proliferación celular.
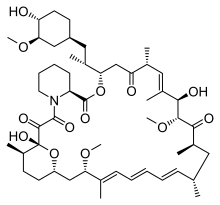
En los últimos años, con el aumento del conocimiento biológico molecular sobre las causas de la PKD, se han encontrado nuevos enfoques terapéuticos. Algunos de estos enfoques se encuentran actualmente en pruebas clínicas . Inicialmente, sin embargo, fue más un hallazgo incidental: en un estudio retrospectivo de algunos pacientes que habían recibido un riñón extraño, se encontró que el riñón poliquístico restante no aumentó de volumen, pero que algunos de los quistes retrocedieron un poco. El número de pacientes en el primer estudio (n = 4) no fue estadísticamente significativo, pero el efecto se pudo probar estadísticamente en varios modelos animales . La causa obvia de esta mejoría fue la administración de sirolimus (rapamicina), que se administró a los pacientes como fármaco inmunosupresor . Los pacientes con un riñón de donante deben tomar inmunosupresores durante toda su vida para evitar el rechazo del órgano extraño por parte del propio sistema inmunológico del cuerpo . En estudios en humanos, el tratamiento con los inhibidores de mTOR sirolimus y everolimus redujo el aumento del volumen renal, pero no la disminución progresiva de la función renal.
Además del sirolimus y derivados de este compuesto, también se investiga sobre otras sustancias potenciales, algunas de las cuales utilizan otras vías de señalización. Así, por ejemplo, cAMP - antagonistas de somatostatina y vasopresina potencial fármaco debido a niveles elevados de cAMP estimulan la proliferación y la secreción de las células epiteliales quística.
La triptolida es una pequeña molécula aislada de una droga tradicional china (Thunder God Vine) que tiene propiedades antiproliferativas y proapoptóticas . La triptolida promueve la liberación de calcio a través de una vía metabólica dependiente de la poliquistina-2 e inhibe la formación y el crecimiento de quistes en modelos animales.
Inhibición de la secreción de líquidos.
Los niveles de hormona antidiurética (vasopresina) aumentan en pacientes con poliquistosis renal . Se expresa el receptor de vasopresina V2 en el túbulo distal y el conducto colector . Estos son los lugares de la nefrona donde tiene lugar la formación del quiste. La vasopresina estimula la formación de AMPc en el túbulo distal a través del receptor V2.
En el modelo animal, los antagonistas del receptor V2 inhiben la formación de cAMP, el aumento de tamaño de los riñones y la formación de quistes y protegen la función renal.
El tolvaptán, antagonista del receptor V2, demostró ser seguro y bien tolerado en pacientes con PQRAD en estudios de fase II / III . Se realizó un estudio doble ciego controlado con placebo en pacientes con PQRAD, con función renal normal y con un volumen renal superior a 750 ml. El tolvaptán puede retrasar la progresión de la enfermedad. El tolvaptán está aprobado en Europa para el tratamiento de la PQRAD desde mayo de 2015.
Complicaciones
Las complicaciones típicas de los riñones quísticos son el aumento de la presión arterial debido a la estimulación del sistema renina-angiotensina-aldosterona e infecciones del tracto urinario .
Las infecciones del tracto urinario, debido a que el tracto urinario es más corto, afectan particularmente a las pacientes. La mayoría de los casos son infecciones de la vejiga urinaria causadas por gérmenes gramnegativos y nosocomiales . Las infecciones del tracto urinario se tratan sintomáticamente, preferiblemente con antibióticos lipofílicos . Las infecciones extremas, como la pionefrosis ( hidronefrosis purulenta ), pueden provocar la extirpación del riñón afectado ( nefrectomía ).
Si bien la incidencia de cálculos renales en la población ronda el 5%, estos depósitos afectan del 10 al 34% de los pacientes con poliquistosis renal. Una posible causa del aumento de la incidencia de cálculos renales es el bajo nivel de pH en la orina de los afectados.
Según el autor y el estudio realizado, del 25 al 75% de todos los pacientes con PQRAD con riñones quísticos también tienen quistes hepáticos . El número de quistes hepáticos aumenta con la edad del paciente. Las mujeres tienen un número cada vez mayor de quistes en el hígado. Debido a los quistes, el hígado puede agrandarse considerablemente y, literalmente, estar impregnado de quistes. En la mayoría de los casos, sin embargo, la función de las células parenquimatosas no se ve afectada. Por ejemplo, los niveles de enzimas hepáticas y bilirrubina son normales. Las complicaciones más extensas surgen del requerimiento de espacio del hígado a veces extremadamente agrandado. Por ejemplo, es posible que el diafragma esté elevado , secciones individuales del intestino se estrechen, lo que puede dificultar el transporte de alimentos, y los vasos sanguíneos más grandes, como la vena cava inferior , pueden obstruirse .
ARPKD conduce a fibrosis, cirrosis y aumento de la presión en la vena porta ( hipertensión portal ) en el hígado .
En otros órganos como el páncreas , el bazo o los ovarios , los quistes son mucho menos comunes en pacientes con riñones poliquísticos.
Ya en 1904 se describió una conexión entre los riñones poliquísticos y los aneurismas cerebrales . Los datos de prevalencia varían entre el 4,5 y el 22,5%. Un posible desgarro (ruptura) del vaso sanguíneo afectado es una de las complicaciones más temidas en los riñones quísticos y es fatal en casi el 50% de los casos.
historia
El cirujano parisino Félix Lejars (1863-1932) utilizó por primera vez el término riñones poliquísticos en su disertación en 1888 . El médico canadiense William Osler lo describió en 1915. Hasta mediados del siglo XX, solo unas pocas publicaciones se ocupaban de este cuadro clínico. En su disertación en 1957, Dalgaard fue el primero en reconocer la herencia autosómica dominante de la PQRAD. En 1985, Reeders y sus colegas descubrieron el locus del gen PKD1 en el cromosoma 16 en humanos.
literatura
Artículo técnico
- W. Kühn, G. Walz: Enfermedad renal poliquística autosómica dominante. En: Dtsch Arztebl. , 104, 2007, págs. A3022-A3028.
- I. Ishikawa: Enfermedad quística renal adquirida. En: The Cystic Kidney. Kluwer, 1990, ISBN 0-7923-0392-X , págs. 351-377.
- JJ Grantham, PA Gabow: Enfermedad renal poliquística. En: Enfermedades del riñón. Little Brown, 1988, págs. 583-615.
- Joachim Frey : Riñones quísticos y otras anomalías congénitas. En: Ludwig Heilmeyer (ed.): Libro de texto de medicina interna. Springer-Verlag, Berlín / Göttingen / Heidelberg 1955; 2da edición, ibid.1961, p. 974 f.
Libros de referencia
- ML Watson (Ed.): Enfermedad renal poliquística. Universidad de Oxford. Prensa, 1996, ISBN 0-19-262578-0 .
- HM Sass, P. Schröder (Ed.): Educación del paciente en caso de riesgo genético. LIT Verlag, 2003, ISBN 3-8258-4987-2 , págs. 147-198.
Información del paciente
- AB Chapman, LM Guay-Woodford: La familia y la PQRAD: una guía para niños y padres. Fundación de Investigación del Riñón Poliquístico, 1997, ISBN 0-9614567-5-2 .
- Hojas de información sobre riñones quísticos en una carpeta de anillas . Asociación de pacientes de PKDeV
Ciencia popular
- T. Kotlorz: Nueva esperanza para los pacientes renales. En: Die Welt , 23 de julio de 2007
- H. Jänz: Esperando el riñón. En: Die Welt , 3 de junio de 2006
enlaces web
- Riñones quísticos familiares con PKD e. V.
- Libro de texto de urología: Enfermedad renal poliquística autosómica dominante (PQRAD)
- zystennieren.de Ruhr University Bochum
- PathoPic - Base de datos de imágenes de la Universidad de Basilea: angiograma post mortem de un riñón quístico (imagen de una muestra)
- PathoPic - Base de datos de imágenes de la Universidad de Basilea: ADPKD (Potter Tipo I) (imagen de un espécimen)
- PathoPic - Base de datos de imágenes de la Universidad de Basilea: Riñón poliquístico tras insuficiencia renal terminal (imagen de una preparación)
- PathoPic - Base de datos de imágenes de la Universidad de Basilea: ARPKD (Potter Tipo I) (imagen de un espécimen)
- PathoPic - Base de datos de imágenes de la Universidad de Basilea: dos riñones poliquísticos y un riñón trasplantado (imagen de una muestra)
Videos
- Profesor Obermüller: Los riñones quísticos explicados claramente: ataques a un órgano de alto rendimiento en YouTube
- Informes afectados en YouTube
Evidencia individual
- ^ S. Wang et al.: La proteína de la enfermedad renal poliquística autosómica recesiva se localiza en los cilios primarios, con concentración en el área basal del cuerpo. En: J Am Soc Nephrol . , 15, 2004, págs. 592-602. PMID 14978161
- ↑ a b c d e f g h i j k l m n o p q r s t U. Faber: Evolución a largo plazo de la degeneración renal poliquística del adulto después de un trasplante de riñón. Tesis, Universidad Heinrich Heine de Düsseldorf, 2000.
- ^ J. Milutinovic et al.: Enfermedad renal poliquística autosómica dominante: síntomas y hallazgos clínicos. En: QJ Med. , 53, 1984, págs. 511-522. PMID 6240069
- ^ LW Elzinga et al.: Manejo quirúrgico de riñones poliquísticos dolorosos. En: Am J Kidney Dis . , 22, 1993, págs. 532-527. PMID 8213792
- ↑ LW Elzinga et al.: Cirugía en el manejo de la poliquistosis renal autosómica dominante. En: Am. J. Kidney Dis. , 1992, págs. 89-92. PMID 1739090
- ↑ D. Frang et al.: Un nuevo enfoque para el tratamiento de los riñones poliquísticos. En: Int. Urol. Nephrol. , 20, 1988, págs. 13-21. PMID 3360583
- ↑ LW Elzinga et al.: Cirugía de descompresión del quiste para la poliquistosis renal autosómica dominante . En: J Am Soc Nephrol. , 2, 1992, págs. 1219-1226. PMID 1591362 .
- ↑ BJ Lifson u a..: Papel y resultados a largo plazo de la decorticación laparoscópica en la enfermedad renal poliquística quística solitaria y autosómica dominante. En: J Urol . 159, 1998, págs. 702-705. PMID 9474129
- ↑ AB Chapman et al.: Proteinuria manifiesta y microalbuminuria en la poliquistosis renal autosómica dominante. En: J Am Soc Nephrol. , 5, 1994, págs. 1349-1354. PMID 7894001
- ↑ PA Gabow et al.: Estructura renal e hipertensión en la enfermedad renal poliquística autosómica dominante. En: Kidney International , 38, 1990, págs. 1177-1180. PMID 2074659
- ↑ a b P. A. Gabow: Enfermedad renal poliquística autosómica dominante En: NEJM 329, 1993, págs. 332-342. PMID 8321262
- ^ AB Chapman, PA Gabow: Hipertensión en la enfermedad renal poliquística autosómica dominante. En: Kidney Int Suppl , 61, 1997, págs. 71-73. PMID 9328971
- ^ PA Gabow et al.: Utilidad de la ecografía en el diagnóstico de la enfermedad renal poliquística autosómica dominante en niños. En: J Am Soc Nephrol. , 8, 1997, págs. 105-110. PMID 9013454
- ^ WC O'Neill et al.: Evaluación ecográfica de la gravedad y progresión de la poliquistosis renal autosómica dominante: el Consorcio de Estudios de Imágenes Renales en Enfermedad Poliquística del Riñón (CRISP). En: Am J Kidney Dis. , 46, 2005, págs. 1058-1064. PMID 16310571
- ↑ KM Koch et al.: Nefrología clínica. Urban y Fischer-Verlag, 1999, ISBN 3-437-21730-5 , págs. 437-459.
- ↑ V. Osathanondh, EL Potter : patogenia de los riñones poliquísticos. En: Arch. Path. , 77, 1964, págs. 459-465. PMID 14120681
- ↑ B. Hermanns et al.: Patología y genética de los riñones quísticos hereditarios. En: Der Pathologe , 24, 2003, págs. 410-420. PMID 14605845
- ↑ ADPKD (Enfermedad renal poliquística autosómica dominante) ( página ya no disponible , búsqueda en archivos web ) University Hospital Aachen; Consultado el 30 de septiembre de 2008.
- ↑ a b c S. Helmig: Investigación genética poblacional sobre el gen PKD 1 del gato con respecto al síndrome poliquístico. Disertación, Universidad Justus Liebig Giessen, 2005.
- ↑ F. Hildebrandt, M. Wolf: Patología y genética de los riñones quísticos hereditarios. En: Terapia Médica. Springer, 2005, ISBN 3-540-21226-4 , págs. 927-939.
- ↑ a b c d e f g W. Kühn, G. Walz: Enfermedad renal poliquística autosómica dominante. En: Ärzteblatt , 104/2007, págs. A3022 - A3028.
- ^ RG Elles et al.: Diagnóstico de la enfermedad renal poliquística del adulto mediante marcadores genéticos e imagen ecográfica en un registro familiar voluntario. En: J Med Genet , 31, 1994, págs. 115-120. PMID 8182715 .
- ↑ LF Fried et al.: Obstrucción duodenal en la enfermedad renal poliquística. Presentación de un caso y revisión de la literatura. En: Am. J. Nephrol. , 18, 1998, págs. 318-320. PMID 9653836
- ↑ a b P.D. Wilson: Enfermedad renal poliquística. En: N Engl J Med. , 350, 2004, págs. 151-164. PMID 14711914 .
- ↑ U. Frei, HJ Schober-Halstenberg: Terapia de reemplazo renal en Alemania. (PDF; 1,4 MB) En: Informe anual 2005/2006 de QuaSi-Niere. Berlina
- ↑ GM Fick, PA Gabow: Enfermedad quística hereditaria y adquirida del riñón. En: Riñón Int. , 46, 1994, págs. 951-964. PMID 7861721 .
- ^ R. Rohatgi: manifestaciones clínicas de la enfermedad renal quística hereditaria. En: Frente Biosci. , 13, 2008, págs. 4175-4197. PMID 18508505
- ↑ enfermedad renal, quística medular, autosómica dominante, con o sin hiperuricemia orpha.net; Consultado el 4 de octubre de 2008.
- ↑ M. Attanasio et al.: La pérdida de GLIS2 causa nefronoptisis en humanos y ratones por aumento de la apoptosis y fibrosis. En: Nature Genet . , 39, 2007, págs. 1018-1024. PMID 17618285
- ↑ a b B. Buchholz: Interacción funcional de policistina 2 y TRPV4. Disertación, Universidad Albert Ludwig de Friburgo, 2004.
- ^ AR Gallagher et al.: Base molecular de la enfermedad renal poliquística autosómica dominante. En: Cellular and Molecular Life Sciences , 59, 2002, págs. 682-693. PMID 12022474 .
- ↑ PQRAD (Enfermedad renal poliquística autosómica dominante) . ( Página ya no disponible , búsqueda en archivos web ) University Hospital Aachen; Consultado el 11 de noviembre de 2008.
- ^ DW Bianchi et al.: Fetología. McGraw-Hill Professional, 2000, ISBN 0-8385-2570-9 , pág.632 .
- ↑ PA Gabow et al.: Factores que afectan la progresión de la enfermedad renal en la poliquistosis renal autosómica dominante. En: Riñón Int. , 41, 1992, págs. 1311-1319. PMID 1614046
- ^ AC Ong, PC Harris: patogénesis molecular de la PQRAD: el complejo de policistina se vuelve complejo. En: Riñón Int. , 67, 2005, págs. 1234-1247. PMID 15780076
- ^ S. Rossetti et al.: Análisis de mutaciones de todo el gen PKD1: implicaciones genéticas y diagnósticas. En: Am. J. Hum. Gineta. 68, 2001, págs. 46-63. PMID 11115377
- ^ GG Germino: Enfermedad renal poliquística autosómica dominante: un modelo de dos efectos. En: Hosp Pract. , 32, 1997, págs. 81-82, 85-88, 91-92. PMID 9078975
- ↑ Y. Pei et al.: Las mutaciones somáticas de PKD2 en quistes de riñón e hígado individuales apoyan un modelo de "dos golpes" de cistogénesis en la enfermedad renal poliquística autosómica dominante tipo 2. En: J Am Soc Nephrol. , 10, 1999, págs. 1524-1529. PMID 10405208
- ↑ F. Qian et al.: La base molecular de la formación de quistes focales en la enfermedad renal poliquística autosómica dominante humana tipo I. En: Cell , 87, 1996, págs. 979-987. PMID 8978603
- ↑ T. Watnick et al.: Las mutaciones de PKD1 en los quistes de ADPKD2 sugieren un efecto patogénico de mutaciones transheterocigóticas. En: Nature Genetics , 25, 2000, págs. 143-144. PMID 10835625
- ↑ K. Hackmann: Investigaciones sobre la expresión de los genes murinos Pkd1 y Pkd2, los genes ortólogos de la enfermedad renal poliquística autosómica dominante (ADPKD). (PDF) Disertación, Universidad de Bielefeld, 2005.
- ↑ W. Lu et al.: Inicio tardío de quistes renales y hepáticos en heterocigotos dirigidos a Pkd1. En: Nature Genetics , 21, 1999, págs. 160-161. PMID 9988265
- ↑ G. Wu et al.: La inactivación somática de Pkd2 produce poliquistosis renal. En: Cell , 93, 1998, págs. 177-188. PMID 9568711
- ↑ N. Bogdanova et al.: Heterogeneidad genética de la poliquistosis renal en Bulgaria. En: Hum Genet. 95, 1995, págs. 645-650. PMID 7789949
- ↑ MC Daoust et al.: Evidencia de un tercer locus genético para la enfermedad renal poliquística autosómica dominante. En: Genomics , 25, 1995, págs. 733-736. PMID 7759112
- ^ AD Paterson, Y. Pei: ¿Existe un tercer gen para la poliquistosis renal autosómica dominante? En: Kidney International , 54, 1998, págs. 1759-1761. PMID 9844156
- ↑ M. Koptides, CC Deltas: Enfermedad renal poliquística autosómica dominante: genética molecular y patogénesis molecular. En: Hum Genet. , 107, 2000, págs. 115-126. PMID 11030408
- ↑ M. Consugar et al.: PKD3 revisado con mejor detección de haplotipos y mutaciones de PKD1 y PKD2. En: J Am Soc Nephrol. , 16, 2005, página 358A.
- ^ AD Paterson, Y. Pei: PKD3 : ¿ser o no ser? En: Nephrol Dial Transplant , 14, 1999, págs. 631-614. PMID 10570111
- ↑ Y. Pei et al.: Enfermedad bilineal y transheterocigotos en la poliquistosis renal autosómica dominante. En: Am J Hum Genet. 68, 2001, págs. 355-363. PMID 11156533
- ^ A b S. Rosetti, PC Harris: Correlaciones genotipo-fenotipo en la enfermedad renal poliquística autosómica dominante y autosómica recesiva. En: J Am Soc Nephrol. , 18, 2007, págs. 1374-1380. PMID 17429049
- ↑ a b C. Boucher, R. Sandford: Enfermedad renal poliquística autosómica dominante (ADPKD, MIM 173900, genes PKD1 y PKD2, productos proteicos conocidos como policistina-1 y policistina-2). En: Eur J Hum Genet. , 12, 2004, págs. 347-354. PMID 14872199 .
- ↑ C. Stayner, J. Zhou: Canales de policistina y enfermedad renal. En: Trends in Pharmacological Sciences , 22, 2001, págs. 543-546. PMID 11698076
- ^ T. Watnick, G. Germino: De cilios a quiste. En: Nature Genetics , 34, 2003, págs. 355-356. PMID 12923538
- ^ BK Yoder: papel de los cilios primarios en la patogenia de la enfermedad renal poliquística. En: J Am Soc Nephrol. , 18, 2007, págs. 1381-1388. PMID 17429051
- ↑ BK Yoder et al.: Patogenia molecular de la poliquistosis renal autosómica dominante. En: Expert Rev Mol Med. , 17, 2006, págs. 1-22. PMID 16515728
- ↑ KD Gardner et al .: Por qué crecen los quistes renales. En: Am J Physiol. , 266, 1994, F353-359. PMID 8160782
- ↑ D. Rizk, AB Chapman: Enfermedades renales quísticas y hereditarias. En: Am J Kidney Dis. 42, 2003, págs. 1305-1317. PMID 14655206
- ↑ MHK Shokeir: Expresión de la enfermedad renal poliquística del adulto en la infancia: un estudio longitudinal. En: Clin. Gineta. , 14, 1978, págs. 61-72. PMID 688689
- ↑ N. Gretz et al .: ¿Es el género un determinante para la evolución de la insuficiencia renal? Un estudio en la enfermedad renal poliquística autosómica dominante. En: Am J Kidney Dis. , 14, 1989, págs. 178-183. PMID 2672797 .
- ↑ R. Sherstha et al.: La terapia con estrógenos posmenopáusicos estimula selectivamente el agrandamiento hepático en mujeres con enfermedad renal poliquística autosómica dominante. En: Hepatology , 26, 1997, págs. 1282-1286. PMID 9362373 .
- ↑ PC Harris et al.: El número de quistes, pero no la tasa de crecimiento quístico, está asociado con el gen mutado en la PQRAD. En: J Am Soc Nephrol. , 17, 2006, págs. 3013-3019. PMID 17035604
- ^ R. Magistroni et al.: Correlación de la función genotípica en la enfermedad renal poliquística autosómica dominante tipo 2. En: J Am Soc Nephrol. , 14, 2003, págs. 1164-1174. PMID
- ^ SR Orth et al.: Fumar como factor de riesgo de insuficiencia renal terminal en hombres con enfermedad renal primaria. En: Riñón Int. 54, 1998, págs. 926-931. PMID 9734618
- ↑ SR Orth et al.: El tabaquismo como factor de riesgo de insuficiencia renal terminal en pacientes con enfermedad renal primaria. En: Contrib Nephrol. 130, 2000, págs. 109-123. PMID 10892557 .
- ↑ a b N. Hateboer: Comparación de fenotipos de poliquistosis renal tipos 1 y 2. En: The Lancet , 353, 1999, págs. 103-107. PMID 10023895
- ↑ GM Fick et al.: Causas de muerte en la poliquistosis renal autosómica dominante. En: J Am Soc Nephrol. , 5, 1995, págs. 2048-2456. PMID 7579053
- ^ Enfermedad renal poliquística autosómica recesiva (ARPKD), análisis genético completo. Clínica Médica Mayo; consultado el 16 de enero de 2018.
- ^ R. Witzgall: Nuevos desarrollos en el campo de las enfermedades renales quísticas. (PDF; 250 kB) En: Current Molecular Medicine , 5, 2005, págs. 455-465. PMID 16101475 .
- ↑ K. Zerres et al.: Enfermedad renal poliquística autosómica recesiva. En: J Mol Med. , 76, 1998, págs. 303-309. PMID 9587064
- ↑ ST Shaikewitz et al.:. Enfermedad renal poliquística autosómica recesiva: cuestiones relativas a la variabilidad de la presentación clínica. En: J Am Soc Nephrol. , 3, 1993, págs. 1858-1862. PMID 8338916
- ↑ EC cap: Estudios de biología molecular sobre el gen PKD1 en gatos. Tesis, Universidad Justus Liebig de Giessen, 2008.
- ↑ MZ Zhang et al.: La proteína PKHD1 codificada por el gen de la poliquistosis renal autosómica recesiva se asocia con los cuerpos basales y los cilios primarios en las células epiteliales renales. En: Proc Natl Acad Sci USA , 101, 2004, págs. 2311-2316. PMID 14983006
- ↑ LM Guay-Woodford: Enfermedades quísticas renales: diversos fenotipos convergen en el complejo cilio / centrosoma. En: Nefrología pediátrica , 21, 2006, págs. 1369-1376. PMID 16823577
- ↑ T. Benzing et al.: Señalización de Wnt en la poliquistosis renal . En: J Am Soc Nephrol. , 18, 2007, págs. 1389-1398. PMID 17429050
- ↑ SJ Ansley et al.: La disfunción basal del cuerpo es una causa probable del síndrome de Bardet-Biedl pleiotrópico. En: Nature , 425, 2003, págs. 628-633. PMID 14520415
- ↑ Sampson et al.: Enfermedad quística renal en la esclerosis tuberosa: papel del gen 1 de la poliquistosis renal. En: Am J Hum Genet. , Octubre de 1997; 61 (4), págs. 843-851. PMID 9382094 .
- ↑ AA Connacher et al.: Síndrome orofaciodigital tipo I asociado a riñones poliquísticos y agenesia del cuerpo calloso. En: J. Med. Genet. , 24, 1987, págs. 116-122. PMID 3560170
- ↑ SA Feather et al.: El síndrome oral-facial-digital tipo 1 es otra enfermedad renal poliquística dominante: características clínicas, radiológicas e histopatológicas de una nueva parentela. En: Nephrol Dial Transplant . , 12, 1997, págs. 1354-1361. PMID 9249769
- ^ E. Prati: síndrome Oro-facio-digital tipo 1. (PDF) En: Enciclopedia Orphanet. Octubre de 2004.
- ↑ K. Zerres, S. Rudnik-Schöneborn: Enfermedades poliquísticas del riñón. En: Manual de Medicina Molecular. Springer-Verlag, Volumen 7 (Parte 2), 2000, págs. 281-295.
- ↑ a b M. A. Matson, EP Cohen: Enfermedad renal quística adquirida: ocurrencia, prevalencia y cánceres renales. En: Medicine (Baltimore) , 69, 1990, págs. 217-226. PMID 2374506
- ^ W. Remmele: Pathologie 5. Springer, 1997, ISBN 3-540-61098-7 , p. 172.
- ^ Universidad de Basilea: Quiste renal secundario después de la diálisis debido a una nefropatía por analgésicos. Imagen de una muestra histológica; Consultado el 8 de septiembre de 2008.
- ↑ FA Belibi et al.: El efecto de la cafeína en las células epiteliales renales de pacientes con enfermedad renal poliquística autosómica dominante. En: J Am Soc Nephrol. , 13, 2002, págs. 2723-2729. PMID 12397042
- ↑ M. Schmid et al.: Relación natriuresis-presión en la poliquistosis renal. En: J. Hypertens. , 8, 1990, págs. 277-283. PMID 2159509
- ^ BZ Colleen: Enfermedad renal poliquística: una descripción general y un comentario. En: Diálisis y trasplante , 28, 1999, págs. 468-474.
- ↑ HH Knispel et al .: Trasplante en enfermedad renal poliquística autosómica dominante sin nefrectomía. En: Urol. En t. , 56, 1996, págs. 75-78. PMID 8659014
- ↑ Y. Pirson et al.: Resultado de la terapia de reemplazo renal en la enfermedad renal poliquística autosómica dominante. En: Nephrol Dial Transplant. , 11, 1996, págs. 24-28. PMID 9044324
- ↑ JJ Grantham: Enfermedad renal poliquística : enfermedad antigua en un contexto nuevo. En: Trans Am Clin Climatol Assoc. 113, 2002, págs. 211-224. PMID 12053711
- ↑ JP Calvet: Estrategias para inhibir la formación de quistes en la PQRAD. En.: Clin J Am Soc Nephrol . , 2008; 3 (4), págs. 1205-1211. PMID 18434615
- ↑ S. Qin, M. Taglienti et al.: La falta de ubiquitinación de c-Met conduce a la hiperactivación de la señalización de mTOR en un modelo de ratón de enfermedad renal poliquística autosómica dominante. En: The Journal of Clinical Research, Volumen 120, Número 10, octubre de 2010, págs. 3617-3628, doi: 10.1172 / JCI41531 , PMID 20852388 , PMC 2947217 (texto completo gratuito).
- ↑ AB Chapman: Enfoques para probar nuevos tratamientos en la poliquistosis renal autosómica dominante: conocimientos de los estudios CRISP y HALT-PKD. En: Clin J Am Soc Nephrol. , 3, 2008, págs. 1197-1204. PMID 18579674
- ↑ JJ Grantham et al.: Progresión del volumen en la poliquistosis renal. En: NEJM , 354, 2006, págs. 2122-2230. PMID 16707749
- ↑ JM Shillingford et al .: La vía de mTOR está regulada por la policistina-1 y su inhibición revierte la cistogénesis renal en la poliquistosis renal. En: Proc Natl Acad Sci. , 103, 2006, págs. 5466-5471. PMID 16567633
- ↑ Y. Tao et al.: La rapamicina ralentiza notablemente la progresión de la enfermedad en un modelo de rata de enfermedad renal poliquística. En: J Am Soc Nephrol. , 16, 2005, págs. 46-51. PMID 15563559
- ↑ PR Wahl i.a .: La inhibición de mTOR con sirolimus ralentiza la progresión de la enfermedad en ratas Han: SPRD con enfermedad renal poliquística autosómica dominante (PQRAD). En: Nephrol Dial Transplant. , 21, 2006, págs. 598-604. PMID 16221708 .
- ↑ SM Flechner et al.: Trasplante , 74, 2002, págs. 1070-1076. PMID 12438948
- ↑ AL Serra, D. Poster, AD Kistler, F. Krauer, S. Raina, J. Young, KM Rentsch, KS Spanaus, O. Senn, P. Kristanto, H. Scheffel, D. Weishaupt, RP Wüthrich: Sirolimus y crecimiento renal en la enfermedad renal poliquística autosómica dominante. En: The New England Journal of Medicine , volumen 363, número 9, agosto de 2010, págs. 820-829, ISSN 1533-4406 . doi: 10.1056 / NEJMoa0907419 . PMID 20581391 .
- ↑ G. Walz, K. Budde, M. Mannaa, J. Nürnberger, C. Wanner, C. Sommerer, U. Kunzendorf, B. Banas, WH Hörl, N. Obermüller, W. Arns, H. Pavenstädt, J. Gaedeke, M. Büchert, C. May, H. Gschaidmeier, S. Kramer, KU Eckardt: Everolimus en pacientes con poliquistosis renal autosómica dominante. En: The New England Journal of Medicine , volumen 363, número 9, agosto de 2010, págs. 830-840, ISSN 1533-4406 . doi: 10.1056 / NEJMoa1003491 . PMID 20581392 .
- ↑ a b A. Masoumi et al.: Posibles intervenciones farmacológicas en la poliquistosis renal. En: Drugs , 67, 2007, págs. 2495-2510. PMID 18034588
- ↑ FA Belibi et al.: El AMP cíclico promueve el crecimiento y la secreción en las células epiteliales del riñón poliquístico humano. En: Riñón Int. 66, 2004, págs. 964-973. PMID 15327388
- ↑ T. Yamaguchi et al .: el cAMP estimula la proliferación in vitro de células epiteliales del quiste renal mediante la activación de la vía de la quinasa regulada por señales extracelulares. En: Riñón Int. , 57, 2000, págs. 1460-1471. PMID 10760082
- ^ SJ Leuenroth et al.: Triptolide reduce la cistogénesis en un modelo de PQRAD. En: J Am Soc Nephrol. , 19, 2008, págs. 1659-1662. PMID 18650476
- ↑ SJ Leuenroth et al.: La triptolida es un inhibidor de la poliquistosis renal derivado de la medicina tradicional china. En: Proc Natl Acad Sci. 104, 2007, págs. 4389-4394. PMID 17360534
- ↑ a b V. E. Torres: Papel de los antagonistas de vasopresina. En: Clinical Journal of the American Society of Nephrology , Volumen 3, Número 4, julio de 2008, págs. 1212-1218. doi: 10.2215 / CJN.05281107 . PMID 18434616 . (Revisar).
- ^ VE Torres et al.: Tratamiento eficaz de un modelo ortólogo de enfermedad renal poliquística autosómica dominante. En: Nat Med , 10, 2004, págs. 363-364. PMID 14991049 .
- ↑ Estudio clínico (fase III): "Ensayo TEMPO 3/4" Eficacia y seguridad del tolvaptán en el tratamiento de la enfermedad renal poliquística y sus resultados (TEMPO3 / 4) en Clinicaltrials.gov de los NIH
- ↑ V. Patel, R. Chowdhury, P. Igarashi: Avances en la patogenia y el tratamiento de la poliquistosis renal. En: Opinión actual en nefrología e hipertensión, volumen 18, número 2, marzo de 2009, págs. 99-106, ISSN 1535-3842 . doi: 10.1097 / MNH.0b013e3283262ab0 . PMID 19430332 . PMC 282027 (texto completo gratuito). (Revisar).
- ^ VE Torres: antagonistas de la vasopresina en la poliquistosis renal. En: Seminars in Nephrology , 2008, 28, págs. 306-317. doi: 10.1016 / j.semnephrol.2008.03.003 . PMID 18519091 . (Revisar).
- ↑ VE Torres et al.: Enfermedad de cálculos renales en la poliquistosis renal autosómica dominante. En: Am. J. Kidney Dis. , 22, 1993, págs. 513-519. PMID 8213789
- ↑ J. Milutinovic et al.: Quistes hepáticos en pacientes con enfermedad renal poliquística autosómica dominante. En: Am. J. Med. , 68, 1980, págs. 741-744. PMID 7377224
- ↑ a b E. Higashihara et al.: Aspectos clínicos de la poliquistosis renal. En: J. Urol. 147, 1992, págs. 329-332. PMID 1732586 .
- ^ Y. Itai et al.: Quistes hepatobiliares en pacientes con enfermedad renal poliquística autosómica dominante: prevalencia y hallazgos en la TC. En: Am. J. Roentgenol. 164, 1995, págs. 339-342. PMID 7839965
- ↑ PA Gabow et al.: Factores de riesgo para el desarrollo de quistes hepáticos en la poliquistosis renal autosómica dominante. En: Hepatology , 11, 1990, págs. 1033-1037. PMID 2365280
- ^ E. Levine et al.: Quistes hepáticos en la enfermedad renal poliquística autosómica dominante: estudio clínico y tomográfico computarizado. (PDF) En: Am. J. Roentgenol. , 145, 1985, págs. 229-233. PMID 3875218
- ↑ A. Telenti et al.: Infección por quiste hepático en la enfermedad renal poliquística autosómica dominante. En: Mayo Clin. Proc. 65, 1990, págs. 933-942. PMID 2198396
- ↑ WI Schievink et al.: Aneurismas intracraneales saculares en la enfermedad renal poliquística autosómica dominante. En: J. Am. Soc. Nephrol. 3, 1992, págs. 88-95. PMID 1391712 .
- ↑ AB Chapman et al .: aneurismas intracraneales en la poliquistosis renal autosómica dominante. En: NEJM , 327, 1992, págs. 916-920. PMID 1513348
- ↑ F. Lejars: You gros reins polykystique de l'adult. Disertación, 1888, París
- ↑ B. Schulze: Riñones quísticos: en camino hacia una enfermedad tratable. (PDF) En: MedReport , 44, 2006, p. 5.
- ^ W. Osler: El diagnóstico de riñón poliquístico. En: Internat Clin. , Filadelfia, 2, 1915, págs. 1-5.
- ^ LP Brendan et al.: ¿Sir William Osler realizó una autopsia en el Hospital Johns Hopkins? En: Archives of Pathology & Laboratory Medicine , 2, 132, 2007, págs. 261-264.
- ^ OZ Dalgaard: Enfermedad poliquística bilateral de los riñones. En: Acta Med Scand. , 328, 1957, págs. 1-255. PMID 13469269
- ^ ST Reeders et al.: Un marcador de ADN altamente polimórfico vinculado a la enfermedad renal poliquística del adulto en el cromosoma 16. En: Nature , 317, 1985, págs. 542-544. PMID 2995836