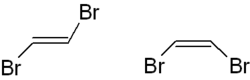Nomenclatura (química)
En química, se entiende que la nomenclatura es la denominación más sistemática e internacionalmente uniforme posible para las sustancias químicas. Hoy en día, es importante que el nombre de una conexión sea único y solo conduzca a una única fórmula estructural . Por ejemplo, el término “ etanol ” solo se refiere al compuesto CH 3 –CH 2 –OH y no a otros compuestos . Por el contrario, los compuestos químicos no tienen un nombre claro, p. Ej. Por ejemplo, el compuesto CH 3 –CH 2 –OH puede denominarse "etanol" así como "alcohol etílico" según varios sistemas de nomenclatura.
historia
Hasta el siglo XVIII, los nombres de las sustancias químicas eran muy inconsistentes. El libro Méthode de nomenclature chimique de Louis Bernard Guyton de Morveau , Antoine Laurent de Lavoisier , Claude Louis Berthollet y Antoine François de Fourcroy en 1787 representó un paso importante hacia la sistematización . Alrededor de 1825, Jöns Jakob Berzelius introdujo el lenguaje de signos químico con letras para elementos químicos una. En 1860, un comité encabezado por Friedrich August Kekulé propuso un sistema de designación internacional para compuestos orgánicos. En 1919 se fundó la Unión Internacional de Química Pura y Aplicada (IUPAC). Desde entonces, ha considerado que el establecimiento de estándares internacionales para la nomenclatura química es su principal tarea.
La nomenclatura de la IUPAC
Para estandarizar las designaciones de los compuestos químicos, existen las directrices vinculantes internacionalmente de la IUPAC (Unión Internacional de Química Pura y Aplicada) y la IUBMB (Unión Internacional de Bioquímica y Biología Molecular), así como su Comisión Conjunta de Nomenclatura Bioquímica, que se configura como un comité de compensación . Estos regulan el uso del inglés. Los nombres en otros idiomas son transferidos en consecuencia por las asociaciones nacionales de químicos. En el área de habla alemana, por ejemplo, el Comité Central Alemán de Química bajo la dirección de Gesellschaft Deutscher Chemiker ( GDCh ) es responsable de la implementación de acuerdo con las sociedades miembros nacionales de la IUPAC en Suiza y Austria. La propia IUPAC también utiliza muchos nombres en inglés en sus listas de elementos en lugar de las abreviaturas de los elementos en las que se basan las abreviaturas de los elementos (por ejemplo, potasio, sodio, tungsteno, mercurio). Las necesidades de los diferentes idiomas e incluso del propio inglés son reconocidas expresamente por la IUPAC. Fueron necesarias regulaciones de nomenclatura particularmente estrictas , especialmente para trabajos índice para sustancias químicas como el Manual de Química Orgánica y Resúmenes Químicos de Beilstein , ya que su sistema de búsqueda de entradas hasta la introducción de la investigación electrónica se basó principalmente en esto.
Dado que la designación sistemática de compuestos químicos de acuerdo con estas reglas a menudo es muy complicada, los químicos continúan utilizando un gran número de nombres tradicionales o nombres cortos reconocidos recientemente creados en el uso diario y en las publicaciones científicas. La IUPAC distingue entre nombres triviales que no tienen relación con la nomenclatura sistemática (z. B. agua , urea o sal de Glauber ), nombre semi sistemático o nombres semi triviales para al menos una parte de un nombre sistemático usando (. Como dióxido de carbono en su lugar de carbono material de dióxido de, tritilo para el grupo trifenilmetilo o glicerina para el propano-1,2,3-triol) y el nombre sistemático ya se ha mencionado. También por la invención de nuevos nombres triviales, p. Ej. B. de sustancias naturales recién descubiertas , existen reglas que cumplen con la IUPAC.
Además, las costumbres nacionales prevalecen con los nombres de los elementos e incluso las raíces del nombre IUPAC no se corresponden consistentemente con el nombre que es decisivo para la abreviatura de la fórmula (por ejemplo, Hg = hydrargyrum, mercurio alemán, raíz IUPAC "mercur" como el mercurio inglés y el mercurio latino ).
Nombres y símbolos de elementos
Los nombres de los elementos químicos los determinan los descubridores. Para elementos nuevos o desconocidos a los que aún no se les ha dado un nombre, existen nombres de elementos sistemáticos que se derivan del número atómico . La tabla periódica de los elementos ofrece una disposición sistemática de los elementos según su configuración electrónica . Para algunos elementos, existen antiguos nombres alemanes que han sido adaptados en varias revisiones por la IUPAC a los del inglés. Este principalmente nombres de elementos en la que las letras k y z a c se intercambiaron. Los ejemplos son calcio - calcio, silicio - silicio o cobalto - cobalto. Pero también se cambiaron algunas otras grafías como yodo que se cambió a yodo o bismuto a bismuto. Si bien los nombres nuevos se usan predominantemente en química, los nombres antiguos todavía se usan en muchas otras áreas y en el área del lenguaje general.
Para cada elemento hay una abreviatura que consta de una a tres letras ( símbolo del elemento ) . Los símbolos de los elementos son válidos internacionalmente, por lo que también se representan en japonés utilizando letras latinas, por ejemplo.
Si desea designar un determinado isótopo de un elemento, coloque su número de masa delante del símbolo del elemento, por ejemplo, 12 C para el isótopo de carbono 12, 235 U para el uranio 235, etc. Los isótopos pesados de hidrógeno , 2 H ( deuterio ) y 3 H ( tritio ), tienen su propio símbolo de elemento con D y T, respectivamente .
Para nombrar conexiones entre diferentes elementos, los nombres de los elementos se modifican parcialmente y se les dan sufijos. Para este propósito , se utiliza la raíz del nombre , que se deriva de los nombres de los elementos latinos o griegos. Así, el oxígeno en el compuesto de aluminio, por ejemplo, ox id (Al 2 O 3 por su nombre raíz) (ox) y la terminación -id especificada.
Prefijos numéricos en nombres químicos
Si un tipo de átomo o grupo de átomos aparece más de una vez en una molécula, el número se indica mediante un prefijo numérico correspondiente (prefijo), que se deriva de los números griegos y se coloca delante del nombre del átomo correspondiente o grupo de átomos. Las excepciones son nona y undeca , que se derivan del latín.
|
|
|
Los prefijos mono y di solo se utilizan para uno y dos. En relación con otros números (21, 101, etc.) se utilizan hen y do . La formación del numeral completo se realiza de atrás hacia adelante .
| Hacer- | -nonaconta- | -tetracta- | -kilia |
|---|---|---|---|
| 2 | 90 | 400 | 1000 |
| 1492 = Dononacontatetractakilia | |||
Ejemplos:
- P 4 S 7 tetra fósforo hepta sulfuro
- SO 3 azufre tri óxido
- CH 2 Cl 2 Di clorometano
Omisión de prefijos numéricos
En el caso de compuestos metálicos, solo se menciona la valencia o número de oxidación que tiene el metal en este compuesto ( enlace iónico ): z. Por ejemplo: CrO 3 óxido de cromo (VI), lea óxido de cromo seis en lugar de trióxido de cromo ( nomenclatura de Stock ). El número de valencia o oxidación se da en números romanos. Si el nombre de una conexión sigue siendo único como resultado, el valor también se puede omitir. Entonces hay z. B. solo un solo óxido de aluminio, a saber, Al 2 O 3 , por lo que simplemente puede escribir óxido de aluminio en lugar de óxido de aluminio (III).
Muy a menudo se omite el prefijo mono- , p. Ej. , NaCl = cloruro de sodio y sin monocloruro de sodio .
Prefijos numéricos alternativos
Si hay varios grupos idénticos para los que el uso de los prefijos anteriores sería ambiguo, se utilizan los siguientes prefijos derivados del griego. De cuatro en adelante, el prefijo numérico simple se usa junto con la terminación -kis .
| número | Prefijo |
|---|---|
| 1 | gallina |
| 2 | a |
| 3 | tris |
| Cuarto | tetrakis |
| 5 | pentakis |
| Sexto | hexakis |
| ... | |
| 21 | henikosakis |
Ejemplos:
- Ca 5 F (PO 4 ) 3 Trisfosfato de fluoruro de pentacalcio - Al usar el prefijo tris, queda inmediatamente claro que no se trata del grupo trifosfato [P 3 O 10 ] 5− , sino de tres grupos fosfato [PO 4 ] 3− .
- 5,6- bis (1,1-dimetilpropil) undecano: el uso del prefijo bis muestra inmediatamente que estamos tratando con dos sustituyentes 1,1-dimetilpropilo idénticos.
Los siguientes prefijos, que se derivan de los números latinos, se utilizan para vincular directamente unidades idénticas :
| número | Prefijo |
|---|---|
| 2 | bi |
| 3 | ter |
| Cuarto | quater |
| 5 | quinque |
| Sexto | sexi |
| Séptimo | septi |
| etc. |
Ejemplo:
- C 6 H 5 -C 6 H 5 se llama Bi fenilo (y no de difenilo o bisfenilo).
Química Inorgánica
Fórmulas de compuestos inorgánicos.
Al escribir fórmulas de compuestos químicos , se sigue esencialmente la escala de electronegatividad de los elementos químicos. Siempre comienza con el socio de conexión más electropositivo, por lo que escribe AgCl, Al 2 O 3 , PCl 5 y no al revés. Los compuestos de hidrógeno son una excepción a esta regla.
Compuestos de hidrógeno
Los átomos de hidrógeno se escriben en último lugar en las fórmulas (NH 3 , SiH 4, etc.). Sin embargo, si es hidrógeno ácido (es decir, el compuesto reacciona ácido en solución acuosa), escriba el hidrógeno al comienzo de la fórmula (HF, HCl, HBr, HI, H 2 O, H 2 O 2 , H 2 S, H 2 Se, H 2 Te). Al nombrar estos compuestos, por ejemplo, además del nombre “fluoruro de hidrógeno” para HF o “ cloruro de hidrógeno” para HCl, también se usa el nombre fluoruro de hidrógeno o cloruro de hidrógeno , que es mucho más común en los laboratorios . Estos últimos son preferibles debido a la designación más clara, ya que estos compuestos no son sales con los aniones correspondientes, sino más bien, debido a los altos números de electronegatividad , solo compuestos dipolo muy parcialmente cargados en los que hay un enlace covalente fuertemente polar (atómico vínculo). Además, debido a la claridad de la denominación, cabe señalar que, por ejemplo, se entiende por "fluoruro de hidrógeno" las sales del tipo MHF o MF × HF (con M = metal monovalente), por lo que se prefiere el fluoruro de hidrógeno. . En el caso de los oxoácidos inorgánicos, el hidrógeno también se escribe al principio de la fórmula, aunque en realidad está unido al oxígeno, es decir, para el ácido sulfúrico, por ejemplo, H 2 SO 4 en lugar de SO 2 (OH) 2 .
radical
Para nombrar el radical, se agrega la terminación -yl al nombre de la raíz. Esto se aplica tanto a la química orgánica como a la inorgánica.
Ejemplos: HO • : hidroxilo (tallo: hidrox-), • CH 3 : metilo (tallo: met-) y R - O • : oxilo (por ejemplo, 2,2,6,6-tetrametilpiperidiniloxilo )
Algunos radicales tienen nombres especiales, especialmente cuando se trata de compuestos de oxígeno.
Química Orgánica
La denominación de compuestos orgánicos de acuerdo con el sistema IUPAC generalmente se basa en un sistema original que puede tener sustituyentes adicionales (residuos). Un sustituyente es un átomo o una combinación de átomos que reemplaza (sustituye) un átomo de hidrógeno en el sistema original. El nombre del sistema principal se usa sin cambios para nombrar el compuesto y los nombres de los grupos sustituyentes se agregan al sistema principal en una forma modificada ( nomenclatura sustitutiva ).
Como complemento del sistema de origen, se añade un descriptor denominado prefijo delante del nombre sistemático de la sustancia para los compuestos correspondientes [p. Ej. B. cis -, trans -, ( E ) -, ( Z ) -, o -, m -, p -, n -, iso -, neo -, ciclo -, sec -, tert -, D -, L - , meso -, (±) -, (+) -, (-) -, ( RS ), ( R ) -, ( S ) -], que describe la configuración o la estereoquímica de la molécula. Los descriptores se utilizan a menudo en combinación con localizadores (por ejemplo, O -, N -, S -, α-, β-, [3.3]) para describir con precisión ciertas posiciones de átomos o enlaces con el fin de nombrar claramente una estructura química.
Soportes
Para obtener fórmulas y nombres inequívocos, las partes de los nombres y la información especial se ponen entre paréntesis en la nomenclatura. Se utilizan tres tipos de corchetes: redondo (), cuadrado [] y rizado {}. El uso de corchetes es diferente en química orgánica e inorgánica. Las unidades que ocurren más de una vez se ponen entre corchetes, a excepción de las unidades de coordinación , que siempre están entre corchetes. En el nombre de los compuestos orgánicos, los corchetes, los corchetes y los corchetes se utilizan de adentro hacia afuera: {[()]}, {[({[()]})]} etc. En las fórmulas, el orden diferente [], Se utilizan [()], [{()}], [({()})], [{({()})}].
En el caso de compuestos sustituidos con isótopos incompletos, los números de artículo y los símbolos de nucleidos se ponen entre paréntesis, por ejemplo, en el caso del dicloro ( 2 H 2 ) metano. En el caso de compuestos específicos, no selectivos, marcados selectivamente, isotópicamente deficientes o enriquecidos, los símbolos de nucleidos con subíndices de multiplicación se colocan entre corchetes, por ejemplo para [ 13 C, 2 H 2 ] metano, [ def 13 C] cloroformo, [ 12 C] cloroformo.
En el caso de los hidrocarburos policíclicos, las posiciones de fusión de las subestructuras se insertan entre corchetes, por ejemplo en el caso del benzo [ a ] antraceno .
En el caso de los hidrocarburos policíclicos con puentes en el sistema de Von Baeyer , después del término ciclo, el número de átomos de carbono en las dos ramas del anillo principal, el puente principal y los puentes secundarios se dan en orden descendente entre corchetes, por ejemplo biciclo [4.4.0] decano . En el caso de puentes insaturados, los localizadores de los enlaces múltiples se dan entre corchetes dentro del término del puente.
En el caso de los hidrocarburos espiro, el término espiro va seguido de las sumas de los átomos de carbono unidos al átomo espiro entre corchetes, por ejemplo, espiro [2.4] heptano. Si tiene que llevarse a cabo una (di) hidrogenación formal para poder implementar un enlace Spiro, el hidrógeno indexado adicional se coloca entre paréntesis directamente detrás del número relacionado con el enlace Spiro.
En el caso de oligosacáridos con un grupo hemiacetal libre, los localizadores de enlace se colocan entre paréntesis entre los nombres de los componentes individuales, por ejemplo, β-D-galactopiranosil- (1 → 4) -α-D-glucopiranosa.
Espacios y guiones
En todos los lugares donde se utilizan espacios en inglés entre las palabras de un nombre, en alemán en química orgánica hay guiones o se omite el espacio. El uso de guiones es un poco arbitrario a veces. Si es por claridad, sea un poco generoso aquí.
Los guiones se utilizan en FÓRMULAS y en NOMBRES:
- Separar locants de palabras o morfemas del nombre. Ejemplo: 2-buteno
- Para separar un descriptor estéreo de un nombre. Ejemplo: ( E ) but-2-en
- Para separar símbolos como µ del resto de la fórmula o el nombre.
- Estructurar descriptores como cyclo , catena , triangulo , quadro , tetrahedro , octahedro , closo , nido , arachno , cis y trans así como z. B. separar Λ y α del resto de la fórmula o del nombre. Los localizadores se separan de la misma forma en los nombres de los agregados o agrupaciones.
- Separar el símbolo del nucleido de etiquetado de su localizador en la fórmula de un compuesto etiquetado selectivamente.
- Separar localizadores pertenecientes a diferentes partes del nombre. Sin embargo, se deben preferir los paréntesis.
- Para separar el nombre de un ligando puente del resto del nombre.
Un guión solo aparece después del paréntesis si el paréntesis de cierre va seguido de un locante, p. Ej. B. Ácido 3- (bromocarbonil) -4- (clorocarbonil) -2-metil-benzoico. Los números (por ejemplo, Tetra) están vinculados a los nombres sin un guión.
Sistemas de maletero
Cadenas lineales
Los sistemas parentales más simples son cadenas lineales de átomos de carbono en las que todos los demás enlaces están saturados con átomos de hidrógeno. Estos hidrocarburos saturados se denominan alcanos y tienen la terminación -an . Para los cuatro alcanos más pequeños, se retienen los nombres metano, etano, propano y butano; para los alcanos restantes, el nombre exacto del compuesto se deriva del número de átomos de carbono según la siguiente tabla . Combine la palabra numérica de la primera década con la palabra numérica de las décadas siguientes. Al final hay una n, que da la terminación típica de alcanos -an .
| 1 | Gallina | 10 | Deca | 100 | Hecta | 1000 | Kilia | |||
| 2 | hacer | Vigésimo | Cosa | 200 | Dicta | 2000 | Dilia | |||
| 3 | Tri | 30 | Triaconta | 300 | Tricta | 3000 | Trilia | |||
| Cuarto | Tetra | 40 | Tetraconta | 400 | Tetracta | 4000 | Tetralia | |||
| 5 | Penta | 50 | Pentaconta | 500 | Pentacta | 5000 | Pentalia | |||
| Sexto | Hexa | 60 | Hexaconta | 600 | Hexacta | 6000 | Hexalia | |||
| Séptimo | Hepta | 70 | Heptaconta | 700 | Heptacta | 7000 | Heptalia | |||
| Octavo | Octa | 80 | Octaconta | 800 | Octacta | 8000 | Octalia | |||
| 9 | Nona | 90 | Nonaconta | 900 | Nonacta | 9000 | Nonalia |
Ejemplos:
- C 32 H 66 = Dotriaconta (Do + Triaconta + n)
- C 99 H 200 = Nonanonacontan (Nona + Nonaconta + n)
- C 403 H 808 = Tritetractano (Tri + Tetracta + n)
- C 4728 H 9458 = Octacosaheptactatetraliano (Octa + Cosa + Heptacta + Tetralia + n)
- C 9999 H 20000 = Nonanonacontanonactanonalian (Nona + Nonaconta + Nonacta + nonalia + n)
Hay excepciones al nombre de acuerdo con la tabla anterior para:
| Número de átomos de carbono | conexión | Apellido |
|---|---|---|
| 1 | CH 4 | metano |
| 2 | C 2 H 6 | Etano |
| 3 | C 3 H 8 | propano |
| Cuarto | C 4 H 10 | butano |
| 11 | C 11 H 24 | Undecano |
| Vigésimo | C 20 H 42 | Icosan |
| 21 | C 21 H 44 | Henicosan |
Si hay un doble enlace en el compuesto, se usa el término alquenos y se usa la terminación -en en lugar de la terminación -an . La posición del doble enlace se indica mediante un número, consulte la numeración a continuación , p. Ej. B.
- CH 2 = CH - CH 2 –CH 3 se llama But-1- en (anteriormente 1-But en ),
- CH 3 –CH = CH - CH 3 significa but-2- ene .
Para cadenas que contienen un triple enlace (= alquinos ), se usa la terminación -in , p. Ej. B.
- CH≡C-CH 2 -CH 3 es but-1- in (anteriormente 1-But in )
- CH 2 = CH - CH 2 –C≡C - CH 2 –CH 3 se llama hept -1-eno - 4- yne .
Si hay varios enlaces dobles o triples, utilice los prefijos multiplicadores di, tri, tetra, penta, hexa, hepta, ...
- CH 2 = CH - CH = CH 2 se llama buta -1,3-dieno ,
- CH≡C - C≡C - C≡C - CH 3 se llama hepta -1,3,5-triine.
Determinación de la cadena principal en hidrocarburos acíclicos ramificados
La cadena principal (sistema de vástago) es la cadena que
- el mayor número de enlaces múltiples contiene
- si (1) es ambiguo: contiene el mayor número de átomos de carbono
- si (2) es ambiguo: contiene el mayor número de dobles enlaces
- si (3) es ambiguo: tiene el conjunto de localizadores más bajo para los enlaces múltiples.
- si (4) es ambiguo: tiene el localizador más bajo establecido para los dobles enlaces.
- si (5) es ambiguo: tiene el mayor número de sustituyentes.
- si (6) es ambiguo: tiene el conjunto de localizadores más bajo para los sustituyentes.
- si (7) es ambiguo: tiene el primer sustituyente en orden alfabético.
- si (8) es ambiguo: tiene el localizador más bajo para el primer sustituyente alfabéticamente.
Nota sobre el conjunto de localizadores : Un conjunto de localizadores es la enumeración de los localizadores como B. 2,4 en 2,4-dimetilheptano. El "conjunto más bajo de localizadores" no significa la suma más pequeña de los localizadores, sino que los localizadores se comparan uno tras otro. El conjunto de locantes más pequeño es el que tiene el locant más pequeño en la primera posición distinguible.
Sistemas cíclicos sin heteroátomos
En los sistemas cíclicos, un ciclo es generalmente el sistema principal.
Sistemas monocíclicos
Si se trata de un compuesto monocíclico , la denominación es la misma que para las cadenas lineales, y además el prefijo Cyclo- se coloca al frente, por lo que z. B. Ciclo hexano . Se conserva el nombre común del benceno . Los compuestos monocíclicos con más de seis átomos de carbono que tienen el número máximo de dobles enlaces no acumulativos pueden denominarse (n) anulenos (n = número de átomos de carbono). Los sistemas cíclicos se designan preferiblemente de acuerdo con el sistema de Hantzsch-Widman .
Sistemas policíclicos condensados
En el caso de los hidrocarburos policíclicos condensados (es decir, los anillos individuales están unidos mediante exactamente un enlace común), el sistema básico es el componente que
- tiene la mayoría de los anillos
- tiene el anillo más grande
Los siguientes policiclos se consideran sistemas separados (en prioridad creciente, el número de anillos entre paréntesis): pentaleno (2), indeno (2), naftaleno (2), azuleno (2), heptaleno (2), bifenileno (3) , as - indaceno (3), s-indaceno (3), acenaftileno (3), fluoreno (3), fenales (3), fenantreno (3), antraceno (3), fluoranteno (4), acetenantrileno (4), Aceantrileno (4), trifenileno (4), pireno (4), criseno (4), naftaceno (4), pléyades (4), piceno (5), perileno (5), pentafeno (5), pentaceno (5), Tetrafenileno (5), hexafeno (6), hexaceno (6), rubiceno (7), coroneno (7), trinaftileno (7), heptafeno (7), heptaceno (7), pirantreno (8), óvalos (10).
Todos los otros anillos se prefijan con el sufijo -eno convertido en -eno (por ejemplo benzo cicloocteno). El tipo de enlace se indica mediante números y letras, pero esto no se explicará con más detalle aquí.
Al nombrar derivados saturados o parcialmente saturados de los policiclos enumerados anteriormente, existe la opción de mostrar los dos átomos de hidrógeno adicionales usando los números de artículo y el prefijo dihidro- si se omite un doble enlace . De manera similar, existen tetrahidro-, hexahidro- , etc. A los sistemas completamente saturados se les da el prefijo perhidro- . Los átomos de hidrógeno individuales se indican mediante el denominado H indexado , que se coloca delante de él en cursiva (por ejemplo, 4 H -pirazol).
Los ciclofanos se pueden nombrar de acuerdo con las mismas reglas, aunque también tienen su propia nomenclatura.
Sistemas policíclicos puenteados
Para los hidrocarburos policíclicos con puentes (es decir, los anillos individuales están unidos por más de un enlace común) se utiliza el sistema de Von Baeyer .
Compuestos de espiro
En los compuestos espiro , los anillos están conectados por un átomo común.
Nomenclatura: sustituyentes -espiro [ número de átomos en el anillo más pequeño . Número de átomos en el anillo más grande ] nombre del tallo (el tamaño del anillo se da sin el átomo de espiro). Ejemplo: 1-bromo-3-cloro-espiro [4.5] decan-7-ol.
Sistemas más complejos
La decisión de lo que ahora se considera el sistema raíz ya no es fácil con conexiones más complejas.
Heterociclos
Si no hay nombres triviales, los heterociclos monocíclicos con hasta 10 miembros del anillo generalmente se nombran de acuerdo con el sistema de Hantzsch-Widman .
En el caso de los policiclos condensados, los heterociclos tienen prioridad sobre los carbociclos (= anillos que solo consisten en átomos de carbono). También existen sistemas con nombres triviales para heterociclos, que se entienden como sistemas de tallo separados (sin clasificación e incompletos):
- Compuestos que contienen O: furano , xanteno , ...
- Compuestos que contienen N: pirrol , imidazol , pirazol , ...
De lo contrario, la denominación de heterociclos sigue en gran medida las reglas dadas anteriormente para sistemas cíclicos sin heteroátomos. A continuación, se indica el tipo y la posición de los heteroátomos utilizando la nomenclatura de sustitución (nomenclatura "a").
Muchos compuestos individuales y grupos de sustancias contienen la terminación -idina (por ejemplo, pirrolidina y anisidina ). En la mayoría de los casos, se trata de compuestos aromáticos que contienen nitrógeno. Sin embargo, la denominación no sigue un sistema coherente.
Sustituyentes (residuos)
Un sustituyente puede, p. Ej. B. ser un grupo funcional , o nuevamente un sistema padre (más pequeño), como una cadena lateral . Las designaciones de los sustituyentes se agregan al nombre del sistema raíz como prefijos o terminaciones (sufijos). La posición exacta del sustituyente se especifica mediante dígitos (consulte la numeración a continuación ).
Si hay varios sustituyentes como prefijos, estos se enumeran en orden alfabético, la multiplicación de prefijos no cambia el orden, por ejemplo , Di b rom- antes de C hlor- (regla: P-14.5.1). Siempre se aplica la primera letra del sustituyente, por ejemplo , D imetilamino (regla P-14.5.2)
Sistemas parentales como sustituyentes
Si el resto es un sistema de raíz, por ejemplo, una cadena lateral o un anillo, la sílaba -yl se agrega a su nombre y el resultado se coloca delante de él como prefijo. El nombre de las cadenas laterales sigue las mismas reglas que para la cadena básica, con las siguientes excepciones:
- en el caso de los alcanos, se omite la terminación -an
- la numeración de la cadena lateral siempre comienza con el eslabón con la cadena principal
Ejemplos:
- Metilo : -CH 3
- Etilo : -CH 2 -CH 3
- Etinilo : -C≡CH
- Prop-2-enilo (alilo): -CH 2 -CH = CH 2
- Ciclohexilo: -C 6 H 11
Los nombres de grupos de elemento-hidrógeno se forman de forma análoga a partir del compuesto original:
- Germyl: -GeH 3
- Sililo: -SiH 3
- Trimetilsililo: -Si (CH 3 ) 3
Si, por ejemplo, al compuesto propano (CH 3 -CH 2 -CH 3 ) todavía se adhiere en el centro de un componente de metano, el compuesto resultante es CH 3 -CH ( CH 3 ) -CH 3 y luego 2-metilpropano . El compuesto CH 3 -CH 2 -CH ( CH 3 ) -CH 2 -CH ( CH 2 CH 3 ) -CH 2 -CH 3 se denomina 3-etil - 5-metil heptano.
Las cadenas laterales con doble conexión a la cadena básica tienen la terminación -ileno ( metileno : = CH 2 ), en el caso de una triple conexión -ilidina ( metilidina : ≡CH).
Grupos funcionales
El grupo funcional más antiguo se agrega como final (sufijo), otros grupos funcionales como prefijos:
- CH 3 –CH ( OH ) –CH 3 se llama propan-2- ol
- CH 3 –CH 2 –CH 2 –C ( OOH ) se llama ácido butanoico
- CH 3 -CH ( OH ) -CH 2 -CH ( NH 2 ) -CH 2 -CH 3 tiene dos grupos funcionales. El alcohol tiene mayor prioridad, por lo que el compuesto se llama 4-amino -2-hexan ol .
Para conocer los nombres de los grupos funcionales individuales y su orden de precedencia, consulte la palabra clave grupo funcional .
Nombres comunes
Para algunos sustituyentes hay nombres triviales, que z. T. también son vinculantes, como B .:
- Fenilo: -C 6 H 5
- Bencilo: -CH 2 -C 6 H 5
- Isopropilo: -CH- (CH 3 ) 2
- Vinilo: -CH = CH 2
- y mucho más metro.
numeración
El sistema maestro está numerado de tal manera que los números recibidos sean lo más pequeños posible. CH 3 –CH 2 –CH 2 –CH (CH 3 ) –CH 3 se llama 2-metilpentano y no 4-metilpentano.
Como en el caso de determinar la cadena principal, la suma de los números de artículo no tiene que ser tan pequeña como sea posible, sino que la primera posición distinguible adquiere el valor más pequeño. CH 3 -CH 2 -CH (CH 3 ) -CH (CH 3 ) -CH 2 -CH 2 -CH 2 -CH 2 -CH (CH 3 ) -CH 3 es por tanto 2,7,8-trimetildecano y no 3 , 4,9-trimetildecano. Esto también se aplica si los números de artículo aparecen más de una vez, por ejemplo, con ClCH 2 –CF 3 ( 2-cloro-1,1,1-trifluoroetano en lugar de 1-cloro-2,2,2-trifluoroetano).
Si solo hay una combinación posible, los números pueden omitirse (por ejemplo, 2-metilpropano = metilpropano , ya que no hay otro metilpropano).
Si las cadenas laterales deben estar numeradas, el punto de conexión a la cadena principal siempre es la posición 1.
Para los derivados de glicerol de origen natural , la nomenclatura sn se aplica a la numeración de los átomos de C según la IUPAC .
En el caso de sistemas policíclicos condensados, puede haber esquemas de numeración vinculantes que deben buscarse en cada caso (ver, por ejemplo, estructura básica de esterano ).
Los números de posición se denominan localizadores .
Sustituyentes que se repiten
Los prefijos multiplicadores di, tri, tetra, penta, hexa, hepta, ... (ver arriba ) se usan para los mismos grupos que ocurren varias veces :
- un anillo de benceno con tres grupos metilo en las posiciones 1, 3 y 5 es 1,3,5- tri benceno de metilo ,
- un metano con cuatro átomos de cloro llamado Tetra clorometano .
- un éter con dos acetato de llama Di éter etílico , etc.
Si el uso de di, tri, tetra, etc. fuera engañoso, por ejemplo, con cadenas laterales sustituidas adicionales idénticas , se deben usar los prefijos alternativos apropiados bis, tris, tetrakis, etc., como se describe anteriormente . Los prefijos bi, ter, quater, etc. se utilizan para unidades idénticas directamente enlazadas.
ejemplo
Según la nomenclatura de la IUPAC, por ejemplo, el compuesto
H 2 N-CH 2 -CH 2 -OH
recibió el nombre de 2-aminoetanol.
Puede obtener este nombre de la siguiente manera:
- Dado que los átomos de carbono solo tienen enlaces sencillos, a la raíz se le asigna "una" como primer final.
- La cadena básica contiene dos átomos de carbono; esto da como resultado la raíz "eth". (→ "ethan").
- Contiene un alcohol (OH) y un grupo amino (NH 2 ) como grupos funcionales . El grupo alcohol tiene la prioridad más alta y tiene prioridad sobre el grupo amino. Entonces se agrega "ol" al final. (→ "etanol").
- El grupo amino no está en el mismo átomo de carbono que el grupo alcohol (átomo n. ° 1), sino en el que está al lado (n. ° 2). Por lo tanto, el lugar está indicado por "2-Amino".
- La combinación de prefijo, raíz y terminaciones da como resultado el nombre "2-aminoetanol".
Estereoquímica
Conexiones quirales
Para distinguir entre compuestos quirales , las diversas formas están precedidas por una ( R ) - o ( S ) - en cursiva . Su uso está determinado por la regla Cahn-Ingold-Prelog (regla CIP) y sus reglas subsidiarias. Si un compuesto quiral está presente como una mezcla de enantiómeros 1: 1, es decir, es un racemato , la designación ( RS ) se coloca al frente. Si la configuración ( R ) - o ( S ) - es incierta o desconocida, esto se indica mediante una (ξ) o (Ξ) - (letra griega Xi).
Para sustancias bioquímicas como carbohidratos y aminoácidos , también se usa a menudo la nomenclatura de Fischer , que usa los prefijos D - y L - (donde D y L se escriben en versalitas ).
Un (+) - o (-) - se utiliza para distinguir la dirección de rotación en compuestos ópticamente activos , por lo que no hay conexión entre la actividad óptica (dirección de rotación) y la "dirección" de quiralidad.
Cabe señalar que las diferentes designaciones ( R , S o D , L y +, -) según los diferentes tipos de nomenclatura no pueden derivarse de las otras designaciones. Solo las reglas del CIP son adecuadas para la designación sistemática de compuestos con varios centros de quiralidad , siendo la nomenclatura de Fischer para el azúcar, por ejemplo, mucho más compacta.
cis - trans isómeros
En la isomería cis - trans , se hace una distinción en la nomenclatura entre compuestos que tienen solo dos sustituyentes diferentes y compuestos con más de dos. Los primeros están marcados con los prefijos cis - o trans - en cursiva . Según IUPAC, cis - dobles enlaces son en su mayoría - pero no siempre - marcados con un precedente, cursiva ( Z ) ( "junto") y trans - dobles enlaces con un ( E ) ( "opuesto"). Estrictamente hablando, en el caso de un isómero ( Z ), esos dos sustituyentes en átomos adyacentes de un doble enlace en el mismo lado de la molécula que tienen la máxima prioridad en el sistema Cahn-Ingold-Prelog , en el caso del ( E ) isómero, los sustituyentes con la mayor prioridad de So CIP en lados opuestos de la molécula.
El trans -1,2-dibromoeteno se muestra a la izquierda, la versión cis a la derecha . También puede utilizar la nomenclatura ( E , Z ) aquí,
- El trans -1,2-dibromoeteno se llama ( E ) -1,2-dibromoeteno,
- cis -1,2-dibromoeteno como ( Z ) -1,2-dibromoeteno
designado.
Aquí, en el anillo, también, los dos átomos de bromo se muestran en las posiciones trans (izquierda) y cis ("juntos" en un lado).
Este es un ( Z ) -3-metilpent-2-eno, ya que los sustituyentes de mayor rango (ver estereoquímica ) están en un lado.
Anómeros
En el caso de los carbohidratos , los anómeros se distinguen por los prefijos en cursiva α - y β - .
bioquímica
IUPAC e IUBMB (Unión Internacional de Bioquímica y Biología Molecular) han compartido pautas para la nomenclatura de enzimas . Según esta nomenclatura, los nombres de las enzimas terminan con -asa y contienen información sobre la función de la enzima. Detalles bajo la palabra clave enzima y en el sitio web de IUBMB.
Además, se desarrolló un sistema de código ( ver números EC ) en el que las enzimas se pueden encontrar bajo un código de cuatro dígitos.
La nomenclatura de ácidos nucleicos se aplica a los ácidos nucleicos .
Estándares de etiquetado fuera de las regulaciones de la IUPAC
La nomenclatura alternativa NXL se utiliza para denotar compuestos hipervalentes. Para el manejo práctico de sustancias químicas en la vida cotidiana, también existen estándares, sistemas numéricos y bases de datos de sustancias de diferentes orientaciones:
- Los números E designan aditivos alimentarios aprobados en la Unión Europea.
- Para los plásticos, existe una abreviatura establecida por la norma ISO . Se utilizan en códigos de reciclaje .
- Los números CAS son identificadores únicos de sustancias químicas y mezclas en forma de números agrupados. En abril de 2018, la base de datos CAS tiene alrededor de 140 millones de entradas.
- Los números ONU válidos internacionalmente se utilizan para mercancías peligrosas . Se asignan a sustancias individuales o grupos del mismo riesgo y son importantes en la cadena logística y para los socorristas.
- Las sustancias que se comercializan en la UE tienen números CE . Se trata de una categoría reguladora importante de la legislación europea sobre productos químicos ( reglamento REACH ).
literatura
- IUPAC, Gerlinde Kruse (Ed.): Nomenclatura de la química orgánica: una introducción. 1ª edición. Wiley-VCH, Weinheim 1997, ISBN 3-527-29327-2 .
- Karl-Heinz Hellwich: nomenclatura química . GOVI-Verlag, Eschborn 2002, ISBN 3-7741-0815-3 .
- D. Hellwinkel: La nomenclatura sistemática de la química orgánica. Un manual de instrucciones . 5., corr., Exp. y edición adicional. Springer, Berlín 2005, ISBN 3-540-26411-6 .
- Martin Negwer, Hans-Georg Scharnow: Drogas químicas orgánicas y sus sinónimos, Vol. 1, 1-4138, Wiley-VCH-Verlag, Weinheim 2007, ISBN 978-3-527-31939-8
- Wolfgang Holland: La nomenclatura en química orgánica . VEB Editorial alemana para la industria básica, Leipzig 1973, DNB 730400123 .
- Philipp Fresenius, Klaus Görlitzer: Nomenclatura químico-orgánica: Conceptos básicos · Reglas · Ejemplos. 4ª edición revisada y ampliada. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1588-5 .
- Ursula Bünzli-Trepp: Nomenclatura de química orgánica, química organometálica y química de coordinación. Logos Verlag, Berlín 2001, ISBN 3-89722-682-0 .
- Wolfgang Liebscher: Manual para la aplicación de la nomenclatura de compuestos químico-orgánicos. Akademie-Verlag, Berlín 1979, DNB 790313952 .
- Wolfgang Liebscher, Ekkehard Fluck (ed.): La nomenclatura sistemática de la química inorgánica. Springer-Verlag, 2013, ISBN 978-3-642-58368-1 , doi : 10.1007 / 978-3-642-58368-1 , 388 páginas.
enlaces web
- Nomenclatura (PDF del Instituto de Química Analítica de la Universidad de Regensburg ; 55 kB)
inglés
- Sitio web de la IUPAC
- Sitio web de IUBMB
- Recomendaciones de la IUPAC sobre nomenclatura, símbolos y terminología orgánicos y bioquímicos, etc. (inglés)
- Normas de la IUPAC sobre nomenclatura en química orgánica
- Nomenclatura IUPAC en estereoquímica
- Comparación de nombres químicos generados con software de nomenclatura y publicados por autores. Gernot A. Eller: Mejora de la calidad de los nombres químicos publicados con software de nomenclatura. En: Moléculas . 2006, 11, págs. 915–928 (artículo en línea en inglés) (PDF; 103 kB)
Evidencia individual
- ^ Nomenclatura IUPAC de Química Orgánica, Introducción, Convenciones R-0.1 .
- ^ Nomenclatura IUPAC de química orgánica, nombres R-0.2.3. .
- ↑ Tabla 11 Términos numéricos básicos (multiplicar afijos). Nomenclatura de Química Orgánica de la IUPAC, Recomendaciones 1993.
- ↑ a b c d e f Wolfgang Liebscher, Ekkehard Fluck: La nomenclatura sistemática de la química inorgánica . Springer-Verlag, 2013, ISBN 978-3-642-58368-1 , pág. 55 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ acdlabs.com: R-0.1.5 Enclosing marks , consultado el 11 de junio de 2017.
- ^ GJ Leigh: Principios de la nomenclatura química, una guía de las recomendaciones de la IUPAC . Real Sociedad de Química, 2011, ISBN 978-1-84973-007-5 , págs. 55 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ IUPAC: Nomenclatura de compuestos orgánicos ( Memento de la original, del 28 de marzo, 2017 el Archivo de Internet ) Información: El archivo de enlace se ha insertado de forma automática y sin embargo no ha sido comprobado. Verifique el enlace original y de archivo de acuerdo con las instrucciones y luego elimine este aviso.
- ↑ Wolfgang Liebscher, Ekkehard Fluck: La nomenclatura sistemática de la química inorgánica . Springer-Verlag, 1998, ISBN 978-3-540-63097-5 , pág. 54 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ Dieter Hellwinkel: La nomenclatura sistemática de la química orgánica - Instrucciones de uso . Springer-Verlag, 2013, ISBN 978-3-662-06684-3 , págs. 3 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ Wolfgang Liebscher, Ekkehard Fluck: La nomenclatura sistemática de la química inorgánica . Springer-Verlag, 1998, ISBN 978-3-540-63097-5 , pág. 63–66 ( vista previa limitada en la búsqueda de libros de Google).
- ↑ Gerlinde Kruse: Nomenclatura de la química orgánica: una introducción . Wiley-VCH, 1997, ISBN 3-527-29327-2 , págs. 3,85 .
- ^ Henri A. Favre, Warren H. Powell: Nomenclatura de la química orgánica. En: pubs.rsc.org. RSC Publishing, 17 de diciembre de 2013, págs. 42-43 , consultado el 3 de enero de 2021 .
- ^ IUPAC : Nomenclatura de lípidos: recomendaciones Lip-1 y Lip-2. .
- ↑ Sustancias químicas - REGISTRO CAS. En: support.cas.org. Consultado el 2 de abril de 2018 .