Hidrato de metano
El hidrato de metano (también llamado clatrato de metano o hidrato de clatrato ( del latín clatratus , 'barred' ), hielo de metano o hielo inflamable ) es una sustancia natural similar al hielo. Está formado por moléculas de agua que forman una estructura de jaula a través de enlaces de hidrógeno , en los que están encerradas las moléculas de metano . El metano atrapado proviene principalmente de la metanogénesis microbiana y en parte de los procesos geológicos. Como una forma altamente concentrada de metano que une grandes cantidades de carbono , el hidrato de metano es un componente importante del ciclo global del carbono .
El físico y químico francés Paul Villard investigó la síntesis de hidrato de metano y sus propiedades fisicoquímicas hacia finales del siglo XIX . Inicialmente se consideró una curiosidad de laboratorio hasta que se identificó como la causa de la obstrucción de las tuberías de gas natural en la década de 1930 .
El hidrato de metano se descubrió por primera vez en la naturaleza en la década de 1960. Se encuentra en todo el mundo en sedimentos a lo largo de los márgenes continentales , en las plataformas de las regiones polares , en las profundidades del mar y dentro y debajo de las áreas de permafrost . Aunque se desconoce la extensión exacta de los depósitos , se cree que el hidrato de metano, que tiene la densidad energética más alta de todas las formas naturales de metano, es uno de los depósitos de energía sin explotar más grandes de la tierra. Las estimaciones de la extensión de los depósitos varían considerablemente , la cantidad de carbono ligado posiblemente excede la suma de todos los demás combustibles fósiles . El desarrollo de aplicaciones técnicas basadas en el hidrato de metano está todavía en pañales e incluye la separación de gases , la desalinización de agua y la investigación espacial .
Se cree que el hidrato de metano, como fuente de metano atmosférico, influyó en el clima geológico . La descomposición del hidrato de metano debido al aumento de las temperaturas ambientales podría liberar el gas de efecto invernadero metano a una escala enorme y, por lo tanto, acelerar el cambio climático provocado por el hombre.
Como parte de los sedimentos marinos , los estabiliza; el papel de la desintegración del hidrato de metano en deslizamientos de tierra submarinos y deslizamientos de tierra no ha sido aclarado de manera concluyente. Los campos de hidrato de metano en el fondo del Golfo de México sirven como hábitat para los gusanos de hielo . Su presunta fuente de alimento son las bacterias que viven en el hidrato de metano y se alimentan de metano.
La posible aparición de hidrato de metano en Marte , Plutón , las lunas de Saturno y Júpiter , objetos transneptunianos , cometas y asteroides es objeto de diversos estudios científicos. El hidrato de metano es posiblemente la fuente de la atmósfera de metano de Titán . Los supuestos depósitos de hidrato de metano en Marte podrían ser importantes para la colonización de Marte .
Clasificación y nomenclatura
El hidrato de metano pertenece al grupo de compuestos de inclusión . Se trata de sustancias químicas en las que un componente huésped forma una cavidad en forma de túneles, canales o capas en las que otros átomos o moléculas están incrustados como componentes invitados. Un subgrupo de compuestos de inclusión son los clatratos o compuestos de jaula. La IUPAC define los clatratos como "compuestos de inclusión en los que la molécula huésped está en una jaula formada por la molécula huésped o por un entramado de moléculas huésped". ( IUPAC : Gold Book) No hay enlace covalente o iónico entre huésped y huésped. , la atracción se debe a las fuerzas de van der Waals .
Los hidratos de gas o hidratos de clatrato, a menudo llamados simplemente hidratos, son compuestos no estequiométricos en los que las moléculas de agua forman las jaulas del huésped, en cuyas cavidades se encierran pequeños átomos o moléculas huéspedes. Si la molécula atrapada es metano, el hidrato de gas se llama hidrato de metano.
El hidrato de metano existe en tres estructuras diferentes llamadas hidrato de metano I, II y H. La Estructura I es la forma más común de hidrato de metano natural. La estructura de las jaulas anfitrionas se describe usando la notación A B , donde A es el número de lados por área de jaula y B es el número de tipos de áreas que componen una jaula en particular. En el hidrato de metano I, las moléculas de agua forman jaulas pentágono- dodecaédrica, que constan de 12 superficies pentagonales con bordes comunes y que se denominan 5 12 jaulas, así como jaulas algo más grandes que constan de superficies hexagonales y pentagonales y se denominan 5 12 6 2 jaulas. La proporción de 5 12 jaulas a 5 12 6 2 jaulas es aproximadamente 1: 3. En el hidrato de metano II, las moléculas de agua forman 5 12 y 5 12 6 4 jaulas. Esta estructura, llamada caedro hexakaide , está formada por moléculas huésped que son más grandes que el metano.
El hidrato de metano de estructura I, que se formó a partir de metano de origen biogénico, contiene casi exclusivamente metano (> 99%) como componente de gas encerrado. Esta forma representa más del 95% de todos los depósitos de hidrato de metano. En el hidrato de metano de estructura II, que es de origen termogénico, existen otros hidrocarburos como el propano además del metano. La Estructura H contiene moléculas aún más grandes, como hexano , metilciclopentano , ciclohexano y metilciclohexano . En el caso del hidrato de metano de origen natural, el metano es, sin embargo, el componente predominante en las dos estructuras.
historia
Primeras observaciones
La primera observación de un hidrato de clatrato probablemente se remonta a Joseph Priestley , quien observó la formación de cristales en 1778 cuando hizo pasar dióxido de azufre a través del agua a alrededor de 0 ° C.
“Había observado que con respecto al aire ácido marino y al aire alcalino que disuelven el hielo, y que el agua impregnada con ellos es incapaz de congelarse, al menos en el grado de frío al que los había expuesto. Lo mismo que encuentro, es el caso del aire con ácido fluorhídrico, pero no es así en absoluto con el aire con ácido vitriólico, que, contrariamente a mis expectativas, encuentro que es completamente diferente. [...] Pero mientras que el agua impregnada con aire fijo la descarga cuando se convierte en hielo, el agua impregnada con aire de ácido vitriólico y luego congelada la retiene con tanta fuerza como siempre ".
“Yo había observado en relación al aire marino ( cloruro de hidrógeno ) y al aire alcalino ( amoniaco ) que disuelven el hielo y que el agua impregnada con ellos es incapaz de congelarse, al menos al nivel de frío que puedo haberlo expuesto. Encuentro lo mismo, es el caso del aire con ácido fluorhídrico ( tetrafluorosilano ), pero no lo es en absoluto con el aire con ácido vitriólico (dióxido de azufre), que, contrariamente a mis expectativas, me parece completamente diferente. [...] Pero mientras que el agua impregnada con aire fijo (dióxido de carbono) lo desprende cuando se convierte en hielo, el agua impregnada con ácido vitriólico y luego congelada lo retiene tan fuerte como siempre ".
Humphry Davy notó un fenómeno similar en 1810 cuando enfrió agua clorada a 9 ° C. Michael Faraday determinó la composición química del hidrato con un mol de cloro por diez moles de agua, siendo la composición real más cercana a un mol de cloro por ocho moles de agua. En la primera mitad del siglo XIX, otros químicos se dedicaron al estudio de los hidratos de gas. El químico Carl Löwig sintetizó el hidrato de bromo en 1829 y Friedrich Wöhler descubrió el hidrato de sulfuro de hidrógeno en 1840 . Zygmunt Wróblewski logró la primera síntesis de hidrato de dióxido de carbono en 1882. Alrededor de 1884, Bakhuis Roozeboom investigó otros hidratos, incluido el hidrato de dióxido de azufre ya descrito por Priestley.
Descubrimiento del hidrato de metano
A partir de 1888 Paul Villard investigó los hidratos de hidrocarburos . En ese año descubrió el hidrato de metano, los hidratos de etano , eteno , etino y óxido nitroso, y en 1890 el hidrato de propano . El hidrato de metano se produce a bajas temperaturas bajo presión con un exceso de gas, el exceso de metano se elimina aliviando la presión. Villard estableció la regla según la cual la composición general de los hidratos de gas se describe mediante la fórmula M + 6 H 2 O; la regla se aplica aproximadamente a las moléculas pequeñas que se encuentran en la estructura I.
En colaboración con Villard, Robert Hippolyte de Forcrand sintetizó los hidratos de clorometano e hidratos de gas mixtos. Logró representar los hidratos de gases inertes como el argón en 1896, el criptón en 1923 y el xenón en 1925. Además, se descubrió la existencia de hidratos dobles, que contienen moléculas de dos sustancias formadoras de hidratos.
El enfoque del trabajo científico en ese momento se concentró en la identificación de compuestos que formaban hidratos, así como en su composición cuantitativa. Aunque otros científicos se volcaron hacia el estudio de los hidratos y sus propiedades y composición química, el campo de la investigación de los hidratos inicialmente no despertó interés industrial.
Bloqueo de tuberías
Esto cambió en la década de 1930 cuando la extracción y el transporte de gas natural en gasoductos a alta presión adquirieron importancia económica. En ciertos tramos de gasoductos, la temperatura disminuyó drásticamente debido al efecto Joule-Thomson . Se encontró una sustancia similar al hielo en estas secciones, que obstruyó las tuberías. Hammerschmidt demostró en 1934 que el metano formaba hidrato de metano con el agua presente en el flujo de gas natural, y que esto obstruía las tuberías y no el hielo, como se suponía originalmente. Su descubrimiento provocó una nueva fase en la investigación del hidrato de metano, ya que los tapones de hidrato de metano en las tuberías de gas natural eran problemáticos para la industria del gas natural, causando pérdidas económicas y riesgos ambientales.
Los problemas y accidentes asociados llevaron a diversas actividades de investigación con el objetivo de prevenir la formación de hidrato de metano en la manipulación de gas natural y petróleo crudo . Entre otras cosas, incluyeron la investigación de aditivos que disuelven el hidrato de metano o inhiben su formación. La investigación de sus límites de estabilidad termodinámica y la cinética de formación y disolución permitió predecir la formación de bloqueos de hidrato de metano en gasoductos. La industria del petróleo y el gas intensificó su investigación luego de comenzar a extraer depósitos de petróleo en las profundidades marinas, donde existen las condiciones necesarias para la formación de hidrato de metano.
Ya a mediados de la década de 1930, se sospechaba que el hidrato de metano era un compuesto de clatrato. Esto se confirmó en las décadas de 1940 y 1950 cuando se llevaron a cabo las primeras investigaciones sobre la estructura cristalina de las estructuras de clatrato y se identificaron las estructuras I y II. También se descubrió que los hidratos mixtos pueden ser más estables y tener un punto de fusión de 10 a 15 ° C más alto . En la década de 1950, el físico holandés Johannes Diderik van der Waals Jr. , hijo del premio Nobel Johannes Diderik van der Waals , junto con JC Plateeuw desarrollaron un modelo termodinámico de hidrato de metano.
Hallazgos de hidrato de metano natural
Ya en la década de 1940 se especulaba sobre los depósitos naturales de hidrato de metano en la zona de permafrost de Canadá. Los hallazgos no pudieron confirmar las suposiciones en este momento. Eso cambió a principios de la década de 1960 cuando Yuri Makogon descubrió que el hidrato de metano se encuentra naturalmente en los sedimentos. A fines de la década de 1960, los equipos de perforación rusos perforaron un pozo en Siberia en los tramos superiores del Messojacha , que encontró por primera vez un depósito de hidrato de metano en la parte superior de un campo de gas natural. Fue la primera confirmación de la presencia de hidrato de metano natural. A principios de la década de 1970, se detectó hidrato de metano en otras áreas árticas , como Alaska y el delta canadiense Mackenzie .
Esto transformó el hidrato de metano de una curiosidad de laboratorio y un peligro operativo para las tuberías de gas natural a una posible fuente de energía , y los hallazgos desencadenaron otra ola de investigación sobre el hidrato de metano. Fueron de interés la investigación de los parámetros geológicos y químicos que controlan la ocurrencia y estabilidad del hidrato de metano en la naturaleza, así como la estimación del volumen de metano en los diversos depósitos de hidrato de metano. En este momento, comenzaron las primeras investigaciones sobre el comportamiento de degradación.
Proyecto de perforación en aguas profundas
El buque de investigación estadounidense Glomar Challenger , una plataforma de perforación para el estudio del hidrato de metano, la tectónica de placas y la paleoceanografía, extrajo sedimentos que contienen hidrato de metano de las profundidades marinas durante varias expediciones como parte del Proyecto de perforación en aguas profundas . El programa de perforación proporcionó a los científicos evidencia de la existencia de hidrato de metano en una variedad de entornos geológicos.
Uno de los objetivos de la misión del Glomar Challenger era investigar la naturaleza de los reflejos acústicos anómalos descubiertos en Blake Ridge, una sección profunda del Océano Atlántico que corre a lo largo de la costa este de los Estados Unidos. Los geólogos descubrieron que los depósitos de hidrato de metano en el fondo del mar pueden detectarse mediante métodos sísmicos de reflexión . Cuando los tiempos de tránsito sísmico cambian de un medio denso a uno menos denso, como ocurre en la base de la zona de estabilidad del hidrato de metano, se crea un reflector llamado simulador de suelo, que es característico del hidrato de metano. Esto fue confirmado por núcleos de sedimentos con altas concentraciones de metano. Los depósitos, que se encuentran a una profundidad de unos 2500 metros por debajo del nivel del mar a profundidades de unos 700 a 750 metros por debajo del fondo del mar , se han estimado en 15 gigatoneladas de carbono.
Como parte del programa, los científicos encontraron hidrato de metano en núcleos de perforación de la Fosa de Centroamérica frente a México y Guatemala . También detectaron depósitos de hidrato de metano donde no había un reflector asociado que simulara el suelo. Los resultados sugirieron que el hidrato de metano se puede encontrar en los márgenes continentales de todo el mundo.
Por primera vez, se propuso la teoría de que la disolución del hidrato de metano podría ser el desencadenante de deslizamientos de tierra submarinos , y que la desintegración del hidrato de metano en el pasado geológico podría haber llevado a una emisión de metano a la atmósfera que influye en el clima. Se consideró una desintegración a gran escala como un intento de explicar la temperatura máxima del Paleoceno / Eoceno .
A fines de la década de 1990, comenzaron las primeras pruebas para descomponer el hidrato de metano en el área de permafrost en Mallik, en el mar de Beaufort . Científicos de EE. UU., Europa, incluidos Alemania, Japón, India y China desarrollaron métodos de minería allí.
Horizonte de aguas profundas
En abril de 2010, ocurrió una explosión en Deepwater Horizon , una plataforma de perforación para exploración petrolera en el Golfo de México . Como resultado, entre 550 y 800 millones de litros de petróleo crudo y aproximadamente 147.000 toneladas de metano se filtraron al mar, lo que provocó el derrame de petróleo en el Golfo de México , el peor desastre ambiental de este tipo en la historia. El hidrato de metano puede haber sido un factor que contribuyó a crear el desastre. Es posible que el pozo haya encontrado hidrato de metano en el sedimento, que podría haberse desintegrado debido a una caída de presión o al calentamiento. Es posible que el metano haya penetrado en el pozo a través de un defecto y contribuido a una alta presión en el pozo, lo que finalmente provocó el reventón , en el que la plataforma se incendió.
Después de la explosión, BP colocó una cúpula de aproximadamente 125 toneladas sobre la fuga más grande del pozo. El aceite se acumularía en la cúpula y se conduciría a través de una tubería a un contenedor de almacenamiento en la superficie. Sin embargo, el metano que escapaba formó hidrato de metano con el agua de mar bajo las temperaturas y presiones predominantes, lo que obstruyó la tubería de descarga y, por lo tanto, obstruyó el drenaje.
Pruebas de producción
En 2012, un estudio de viabilidad probó el intercambio de dióxido de carbono por metano unido en hidrato de metano en el pozo Ignik Sikumi No. 1 en el campo Prudhoe Bay . El metano liberado se transportó aliviando la presión en el depósito. Con base en estudios sísmicos que indican depósitos de hidrato de metano, Japón comenzó a realizar perforaciones de prueba en el noroeste del Pacífico frente a Japón a fines de 1999. La perforación a una profundidad de agua de 945 metros confirmó depósitos de hidrato de metano. Basado en los resultados de la exploración, el gobierno japonés lanzó un programa de investigación para investigar la descomposición del hidrato de metano. En las pruebas de producción de abril de 2017, se extrajo metano del hidrato de metano por primera vez en mar abierto utilizando el método de alivio de presión frente a la isla de Honshu . En el pozo más exitoso, se produjeron un total de 222.500 metros cúbicos de metano en 24 días.
En Prudhoe Bay se realizó una prueba estratigráfica de 2018 perforada y prueba de Methanhydratreservoiren. El conocido como Hydrate-01 está destinado a ser un pozo de monitoreo para pruebas de producción a largo plazo. Entre otras cosas, se investigará la reacción de los depósitos de hidrato de metano al alivio de presión.
Ocurrencia
Se pueden encontrar grandes depósitos de hidrato de metano en los océanos, debajo de la capa de hielo en Groenlandia y el Ártico, en la Antártida y dentro y debajo del permafrost en la tierra y en el permafrost inundado. En general, el 71% de la superficie de la tierra está cubierta por océanos, sus afluentes y aguas interiores, alrededor del 90% de esta área tiene la profundidad de agua necesaria para la formación de hidrato de metano.
Las estimaciones iniciales de la ocurrencia y distribución de depósitos de hidrato de metano submarino datan de la década de 1970 y se basan en la suposición de que ocurren en casi todo el océano desde una profundidad de agua de más de 500 metros. Una estimación en la década de 1990 basada en estudios sísmicos llegó al resultado de que alrededor de 11.000 gigatoneladas de carbono se unían al hidrato de metano.
Las estimaciones basadas en investigaciones recientes asumen una cantidad de entre 500 y 2500 gigatoneladas de carbono unido al hidrato de metano, mientras que la cantidad total de carbono unido orgánicamente sin hidrato de metano es de alrededor de 9.000 gigatoneladas. El Servicio Geológico de los Estados Unidos (USGS), una agencia científica de los Estados Unidos en el campo de la geología , estima la ocurrencia en 1.800 gigatoneladas, un orden de magnitud que también es considerado realista por otros científicos.
En la literatura, el tamaño de los depósitos de hidrato de metano generalmente se da sobre la base del volumen de metano o la masa de carbono. Los volúmenes típicos se expresan en metros cúbicos y, especialmente en la literatura en idioma inglés, en billones de pies cúbicos (TCF). Un billón de pies cúbicos equivale a 28,3 mil millones de metros cúbicos. También es una práctica común indicar el carbono en gigatoneladas o petagramos , especialmente para comparar con otros depósitos de hidrocarburos orgánicos. En condiciones estándar , 1 gigatonelada de carbono equivale aproximadamente a 1,9 billones de metros cúbicos de metano, o una energía equivalente a unos 74 exajulios . Un exajulio (EJ) corresponde a 10 18 julios . En comparación, el consumo anual de energía primaria en Alemania es de alrededor de 13 exajulios.
Ocurrencia marina
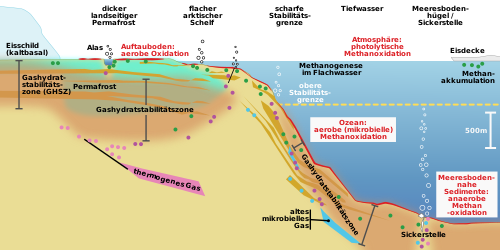
Los hidratos de metano marino se encuentran en las laderas continentales, las laderas de las islas, las escaladas oceánicas y las zonas de aguas profundas en el interior y en los mares marginales . Aquí es donde se produce la mayor producción de metano, ya que una gran cantidad de material de origen biológico llega al fondo marino, que se produce en las zonas altas del mar. Este no es el caso de las grandes llanuras de aguas profundas, por lo que las ocurrencias allí son menos comunes.
Con condiciones adecuadas, es decir, bajas temperaturas, presiones más altas y suficiente metano disponible, es probable que se forme y acumule hidrato de metano. La zona de estabilidad del hidrato de metano está influenciada por varios factores. La sal en el agua de mar conduce a una reducción en la zona de estabilidad; a medida que aumenta el contenido de sal, son necesarias temperaturas más bajas y presiones más altas. Los hidrocarburos de cadena más larga en hidratos mixtos tienen el efecto opuesto y pueden expandir significativamente la zona de estabilidad.
La formación de plancton es alta en las laderas continentales y en los bordes de los mares y lagos interiores . La sedimentación del material orgánico proporciona a los microbios productores de metano la base para la producción de grandes cantidades de metano. Por lo tanto, el hidrato de metano se encuentra en todas las vertientes continentales, así como en el Mar Negro y el Mar Caspio . Con mucho, los depósitos más grandes se encuentran en las profundidades del mar por debajo de una profundidad de al menos 200 metros y son de origen microbiológico, excepto en cuencas termogénicas como el Golfo de México . El Servicio Geológico de los Estados Unidos estima que la ocurrencia total de las profundidades marinas es de alrededor de 1.700 gigatoneladas de carbono y representa más del 95% de todas las ocurrencias de hidratos de metano, con la excepción de las reservas antárticas .
El hidrato de metano se encuentra en sedimentos de grano fino y grueso, y los sedimentos de grano grueso tienen concentraciones más altas de hidrato de metano. Por lo general, se encuentran cerca del fondo del océano a una profundidad de aproximadamente 50 a 160 metros por debajo del fondo del océano. Se han descubierto importantes depósitos de hidrato de metano marino frente a los Estados Unidos, Japón e India en la cuenca de Krishna Godarvi frente a Andhra Pradesh . En la zona de subducción frente a Oregon, la tectónica de placas hace que la placa oceánica Juan de Fuca se sumerja debajo de la placa continental de América del Norte . El sedimento subducido se expulsa a mayores profundidades y el agua de los poros con un alto contenido de metano se transporta hacia arriba. En las proximidades de la superficie del sedimento, este metano disuelto se enfría en el campo de estabilidad del hidrato de metano y se forma hidrato de metano en el sedimento o en la superficie del sedimento. A través de este proceso, la mayor parte del metano ascendente se une al sedimento y se deposita cerca de la superficie del sedimento. Los depósitos en depósitos de arena con alta porosidad se consideran económicamente degradables. El tamaño de los depósitos extraíbles de aguas profundas se estima en alrededor de 657 gigatoneladas.
En 1997, se proporcionó la primera evidencia de hidrato de metano en los sedimentos del lago Baikal en Rusia . En el curso del proyecto “Baikal Drilling”, se detectó el hidrato en el núcleo de sedimento BDP-97. Hasta ahora, se han descubierto 21 sitios con depósitos de hidrato de metano que son termogénicos, microbianos y de origen mixto. Se encontró hidrato de metano en 15 lugares en volcanes de lodo .
El Mar de Siberia Oriental es un mar de plataforma poco profunda formado por las inundaciones del noreste de Siberia durante el aumento del nivel global del mar a principios de la era post-glacial . El permafrost submarino del mar de Siberia Oriental probablemente contiene depósitos de metano importantes pero poco explorados. Estos pueden estar presentes como hidrato de metano en o debajo del permafrost submarino o como gas termogénico.
Ocurrencias terrestres
Los depósitos de hidrato de metano en tierra se encuentran principalmente en áreas de permafrost, que en el hemisferio norte abarcan gran parte de Alaska , Rusia y otros países de la ex Unión Soviética . El metano presente en el permafrost, unido como hidrato de metano en North Slope , una región del estado estadounidense de Alaska, se estima en 16,7 billones de metros cúbicos de metano. Esto significa que la cantidad de metano unido al hidrato de metano supera con creces los recursos de gas extraíble convencionalmente en North Slope.
Las condiciones térmicas para la formación de permafrost e hidrato de metano han existido en el Ártico desde el final del Plioceno hace unos 2,58 millones de años. Las acumulaciones de hidrato de metano presentes en el permafrost probablemente se desarrollaron a partir de depósitos de gas convencionales y son de origen termogénico.
Poco se sabe sobre el tamaño de los depósitos antárticos, las estimaciones son entre 80 y 400 gigatoneladas de carbono. Los depósitos en las laderas continentales superiores se estiman en 63 gigatoneladas y representan aproximadamente el 3,5% de los depósitos de hidrato de metano. Los depósitos en el permafrost en la tierra y en las áreas de permafrost inundadas ascienden a aproximadamente 20 gigatoneladas y representan aproximadamente el 1,1% de los depósitos de hidrato de metano.
Apariciones extraterrestres
La formación original de metano probablemente ocurrió en el medio interestelar antes de que se convirtiera en parte de la nebulosa solar . Las observaciones cerca de objetos estelares jóvenes han demostrado que gran parte del metano interestelar se forma por hidrogenación de carbono en granos de polvo. Durante el enfriamiento de la nebulosa protosolar, se unió como hidrato de metano. De esta forma, formó los bloques de construcción de cometas, cuerpos de hielo y planetas gigantes. El hidrato de metano puede haber jugado un papel importante en la evolución de las atmósferas planetarias . Según los datos de la Voyager 2 , se cree que las lunas de Urano contienen aproximadamente un 7% de hidrato de metano. En Plutón , la ubicación del Sputnik Planitia cerca del ecuador sugiere la presencia de un océano subterráneo y una capa de hielo adelgazada localmente. Para mantener un océano fluido, Plutón necesita mantener el calor adentro. La presencia de una fina capa de hidrato de metano en la base de la capa de hielo podría actuar como un aislante térmico y evitar que el océano se congele por completo. El carbono se ha encontrado en forma de carbonatos y compuestos orgánicos en el planeta enano Ceres , el cuerpo con más agua del sistema solar después de la Tierra. Se cree que el metano está presente en la corteza en forma de hidrato de metano.
Presunta ocurrencia en Marte
Desde 2004, durante varias misiones, como el rover de Marte Curiosity y estudios de observación, se han encontrado rastros de metano en la atmósfera marciana en el rango de 60 partes por mil millones en volumen (ppbv). La fuente de metano en Marte y la explicación de las desviaciones temporales en las concentraciones de metano observadas se desconocen hasta ahora. El dióxido de carbono sólido y el hielo de agua se han observado hasta ahora como fases condensadas en la superficie de Marte. Sin embargo, el hidrato de metano o los hidratos de clatrato mixtos podrían estar presentes bajo tierra y representar una posible fuente de metano atmosférico. Las concentraciones de metano detectadas corresponden a la descomposición de un volumen de aproximadamente 2750 metros cúbicos de hidrato de metano.
Las condiciones termodinámicas permiten la existencia de hidratos de clatrato mixtos, cuya composición corresponde a la atmósfera marciana con dióxido de carbono, nitrógeno , argón y metano. Sin embargo, los hidratos de clatrato enriquecidos con metano en el subsuelo de Marte solo pueden ser estables si ha existido una atmósfera primitiva rica en metano o si una fuente de metano estaba o todavía está presente.
Presunta ocurrencia en Titán
La atmósfera de Titán , la luna más grande de Saturno , está compuesta por un 94,2% de nitrógeno , un 5,65% de metano y un 0,099% de hidrógeno . La sonda Voyager 1 entregó las primeras observaciones detalladas de la atmósfera de titanio en noviembre de 1980 y mostró que la temperatura es de alrededor de 95 Kelvin y que la presión superficial es de 1,5 bar.
La sonda Cassini-Huygens proporcionó una gran cantidad de información sobre Titán desde julio de 2004 después de entrar en órbita. La sonda Huygens aterrizó en Titán en enero de 2005 y envió información sobre la estructura de la atmósfera y la superficie de la luna. Además del etano, se detectaron moléculas orgánicas más complejas.
La densa atmósfera de titanio se mantiene gracias al efecto invernadero del metano. Sin este efecto invernadero, la temperatura atmosférica podría caer por debajo del punto de ebullición del nitrógeno y gran parte de la atmósfera de nitrógeno se licuaría. Sin embargo, los procesos fotoquímicos convierten de manera irreversible el metano en hidrocarburos superiores como el etano durante un período de alrededor de 10 a 100 millones de años, que se licua y se deposita en los lagos de etano. Una capa de hidrato de metano debajo de la superficie se postula como una fuente plausible que podría renovar el contenido de metano en la atmósfera. Es posible que las temperaturas durante la formación de la luna de Saturno fueran tan bajas que el metano en forma de hidrato de metano se incorporó al titanio en cantidades considerables. El metano podría haber sido creado en parte por serpentinización o impactos de cometas y combinado con el agua existente para formar hidrato de metano.
La falta de evidencia de los gases nobles xenón y criptón en la atmósfera de titanio podría ser una indicación más de la presencia de hidrato de metano. Los gases podrían haberse incorporado al hidrato de metano cuando se formó el titanio. Aunque se dan los prerrequisitos termodinámicos y hay muchas indicaciones de la presencia de hidrato de metano en titanio, aún no se ha logrado evidencia directa.
Presunta ocurrencia en Encelado
Con base en las condiciones termodinámicas, se puede esperar que un supuesto océano subglacial interno de Encelado proporcione las condiciones necesarias para la formación de hidrato de metano. Un espectrómetro de masas de iones neutros a bordo de la sonda Cassini fue capaz de detectar dióxido de carbono y amoníaco , así como metano y compuestos orgánicos superiores en las columnas de vapor de agua . En la parte superior del océano, el hidrato de metano y otros hidratos de gas podrían formar una capa en la interfaz entre el hielo y el océano. El hidrato de metano podría descomponerse en la grieta que conecta el océano con la superficie, liberando metano en el proceso.
Aparición
Origen del metano
El metano en el hidrato de metano proviene de fuentes biológicas o termogénicas, así como de la serpentinización del olivino . La mayor parte del metano proviene de la metanogénesis a través de la reducción de dióxido de carbono utilizando hidrógeno producido biológicamente . Se trata de la formación de metano por microbios del dominio de las arqueas o bacterias primordiales, en las que la producción de metano es una forma generalizada de metabolismo. Cuando el material orgánico se hunde en el fondo del mar, primero pasa por varias zonas oxidativas. La zona anaeróbica de formación de metano comienza debajo de las zonas oxidativas. En un ambiente anóxico , es el paso final en la descomposición de la biomasa .
El metano termogénico se produce por la descomposición termocatalítica de moléculas orgánicas complejas. Puede obtenerse craqueando el kerógeno orgánico directamente o a partir del petróleo. Las fuentes de metano termogénico a menudo contienen otros compuestos de carbono ligero como el etano y el propano , que también forman hidratos de gas. Las propiedades físicas y químicas de los hidratos de gas mixtos difieren de las del hidrato de metano puro. En el Golfo de México y el Mar Caspio, el metano termogénico se encuentra principalmente en el hidrato de metano.
La serpentinización del olivino con agua tiene lugar con la formación de magnetita e hidrógeno . El hidrógeno liberado puede reaccionar con el dióxido de carbono para formar metano y agua.
El metano de las diversas fuentes se puede diferenciar utilizando el método Delta-C-13 (δ13C). Aquí δ13C que la relación de isótopos de carbono estable - los isótopos 13 C y 12 C define entre una muestra y un estándar. El metano tiene una firma de δ13C muy empobrecida. Un valor de δ13C mayor que -55 ‰ es característico del metano de origen biogénico, un valor menor de -55 ‰ es característico del metano de origen termogénico.
Formación de hidrato de metano
La cantidad de hidrato de metano que surge en el sitio de formación de metano microbiano es pequeña. La saturación del agua a menudo es solo un pequeño porcentaje de la concentración requerida para la formación de hidrato de metano. Para formar capas de hidrato de metano más grandes, el metano debe migrar a través del transporte de flujo o la difusión a un lugar donde se pueden acumular concentraciones más altas de metano. El transporte de gas libre a través de capas de sedimentos de grano grueso se ha observado en muchas acumulaciones de hidratos de metano.
El hidrato de metano se forma a partir de agua y metano a una presión de alrededor de 2 megapascales , es decir , una profundidad de alrededor de 200 metros, y temperaturas por debajo de 2 ° C a 4 ° C. El hidrato de metano se presenta en tres formas diferentes. El hidrato de metano de estructura I es la forma más común y contiene principalmente metano microbiano y trazas de otros gases. La estructura II y la estructura H a menudo contienen metano termogénico e hidrocarburos de mayor peso molecular. El metano es, con mucho, el gas predominante en todos los hidratos de gas naturales encontrados hasta la fecha.
El diagrama de fases muestra los rangos de presión y temperatura en los que se puede formar el hidrato de metano. La temperatura se traza en el eje de abscisas , el eje de ordenadas muestra la profundidad del mar y, por lo tanto, la presión del fluido. La línea discontinua curva que abarca el área amarilla es el límite de la fase de hidrato de metano. Por encima y a la derecha de este límite, las temperaturas son demasiado altas y las presiones demasiado bajas para la formación de hidrato de metano, de modo que allí está presente metano gaseoso. El hidrato de metano sólido se forma debajo y a la izquierda de este límite. Permanece estable porque las temperaturas son lo suficientemente bajas y las presiones del líquido lo suficientemente altas como para mantener la fase sólida.
Cuando se forma el hidrato de metano, el agua debe estar sobresaturada con metano y también deben prevalecer ciertas condiciones de presión y temperatura. El hidrato de metano solo es estable a altas presiones y bajas temperaturas. Debido a la inclusión de otros gases como el sulfuro de hidrógeno o el dióxido de carbono, se puede formar hidrato de metano incluso a presiones más bajas y temperaturas ligeramente más altas. El proceso de formación del hidrato de metano es similar a la cristalización y se puede dividir en una fase de nucleación y una fase de crecimiento.
Métodos de minería
Dado que el hidrato de metano es un sólido , los primeros conceptos se basaron en tecnologías mineras en las que se extraía mecánicamente hidrato de metano sólido o sedimento que contenía hidrato de metano. Los depósitos de hidrato de metano en grandes depósitos contiguos , en los que el hidrato se encuentra en los espacios porosos permeables de arena o limo, se pueden extraer mediante técnicas de extracción de hidrocarburos. Para descomponerlo, las condiciones de presión y temperatura en el depósito se modifican de tal manera que el hidrato de metano se descompone en sus componentes. El metano libre se puede obtener utilizando métodos de producción de gas natural industrial convencionales.
Las primeras pruebas de producción se llevaron a cabo en el permafrost canadiense cerca de Mallik. La instalación de investigación está ubicada en el lado noroeste de las islas Richards y es parte del delta de Mackenzie, que desemboca en el mar de Beaufort. Allí se encontró hidrato de metano en 1998 como parte de un proyecto de investigación. La evaluación de los núcleos de perforación mostró diez capas de hidrato de metano, que se encuentran a una profundidad de 890 a 1106 metros por debajo del suelo, con un espesor total de más de 110 metros. Con valores de saturación de hidrato de metano que a veces superan el 80% del volumen de poros, el campo de Mallik es uno de los depósitos de hidrato de metano más concentrados del mundo. Los estudios científicos realizados allí sirvieron para desarrollar técnicas de seguridad para la producción de metano a partir de hidrato de metano y permitieron investigar técnicas de perforación y producción con miras a su aplicación industrial. La extracción económica requiere tasas de producción de alrededor de 100.000 metros cúbicos por día por pozo.
La extracción de metano de los depósitos de hidratos de metano representa un desafío técnico y ecológico, durante los primeros pozos, que se basaron en técnicas de perforación convencionales, hubo influencias térmicas y mecánicas en las capas de hidratos de metano. Los problemas causaron, por ejemplo, la liberación de gas natural cuando se perforó inesperadamente un depósito de gas natural libre a alta presión bajo una capa de hidrato de metano. Asimismo, el metano de los hidratos que se desintegran puede escapar fuera del pozo.
Todos los procesos de degradación producen grandes cantidades de agua, ya que se liberan de seis a siete moléculas de agua por molécula de metano. El calor necesario para romper la jaula de hidrato de metano corresponde a aproximadamente el 10% del poder calorífico del metano. Cuando se descompone el hidrato de metano, se espera un descenso de la superficie terrestre, como se puede observar con la explotación de depósitos convencionales.
Método de inyección
La destrucción del hidrato de metano es posible mediante la inyección de agua caliente en el subsuelo que contiene hidrato de metano. El gas metano producido se puede bombear a través de un pozo. Al igual que con todos los demás métodos de producción, es ventajoso utilizar el calentamiento del pozo para evitar la formación de nuevo hidrato de metano en el pozo y en las tuberías de producción.
Alivianador de presión
Además, el hidrato de metano se puede descomponer aliviando la presión. El balance de energía se mejora considerablemente en comparación con el método de inyección y se aumentan las tasas de suministro. El calor para la descomposición del hidrato de metano es suministrado por la formación circundante . La aplicación del método ha demostrado ser muy prometedora en varias pruebas de campo , incluso en Mallik. En las pruebas de producción en alta mar frente a las costas de Japón, se produjo un volumen de producción de 20.000 metros cúbicos por día. La aplicación del método no está exenta de problemas; Después de un tiempo, la capacidad calorífica de la roca circundante se agota y la descomposición del hidrato de metano se detiene. Además, las líneas de transporte están bloqueadas por hielo.
La extracción de metano de los depósitos de hidratos de metano requiere tecnologías de perforación a medida. Grandes recursos se encuentran en depósitos ricos en arena, en los que se pueden acumular altas concentraciones de hidrato de metano debido a la alta permeabilidad del sedimento. La formación de hidrato de metano reduce significativamente la permeabilidad , pero es suficiente para dirigir los cambios de presión de un pozo a un yacimiento.
Intercambio de metano por dióxido de carbono
El metano se puede obtener a partir del hidrato de metano, entre otras cosas, mediante una reacción de intercambio con dióxido de carbono. El secuestro de dióxido de carbono asociado a esto significaría que la extracción y el uso energético del metano obtenido de esta manera sería en gran medida climáticamente neutro. La conversión genera calor porque el hidrato de dióxido de carbono es más estable que el hidrato de metano. Se estima que la entalpía de formación de hidrato de dióxido de carbono a partir de hidrato de metano es de alrededor de 10 a 11 kJ / mol por mol de gas intercambiado. Por tanto, el calor de la formación del hidrato de dióxido de carbono es suficiente para que el hidrato de metano se disocie. El intercambio crea una capa de hidrato de dióxido de carbono, que inhibe cinéticamente cualquier reacción posterior. El rendimiento teórico no se alcanza en este proceso. Los métodos que combinan la reducción de la presión, el suministro de calor y el intercambio de dióxido de carbono son muy prometedores.
Inhibición química
En el método de inhibición química , el hidrato de metano se disuelve inyectando sustancias químicas como el metanol , que reducen la temperatura de formación del hidrato, los denominados inhibidores termodinámicos, en las capas que contienen hidrato de metano. Además del metanol, estos productos químicos incluyen glicoles como etilenglicol , amoníaco y cloruros . Este enfoque se utiliza para prevenir la formación de hidratos de metano y la eliminación de escombros en las tuberías de gas natural. La eficacia del método depende del tipo de inhibidor, la concentración de inhibidor, la presión y la composición del gas formador de hidratos. Los inhibidores termodinámicos deben usarse en cantidades relativamente grandes.
Alternativamente, se pueden usar inhibidores de hidratos cinéticos y antiaglomerantes que evitan la formación de hidratos de metano. Los inhibidores de hidratos cinéticos son típicamente polímeros solubles en agua como polivinilpirrolidona o polivinilcaprolactama de bajo peso molecular, que contienen amida hidrófila y grupos funcionales hidrófobos que se unen a la interfase entre el hidrato de metano y el agua líquida y así retrasan la formación de hidratos.
La aglomeración de hidratos de metano consiste en las etapas de nucleación de hidratos, crecimiento de cristales de hidratos y asociación de aglomerados de hidratos con la formación de agregados más grandes. Los compuestos antiaglomerados, típicamente anfifílicos , tensioactivos, interrumpen las interacciones moleculares entre los agregados de hidratos y las moléculas de agua, que desempeñan un papel crucial en la aglomeración.
Estimulación térmica in situ
Un método utiliza la estimulación térmica in situ mediante la introducción de calor en la zona de hidrato de metano mediante la combustión de aire y gas en un contenedor en el lugar. La combustión proporciona el calor necesario para la descomposición del hidrato de metano. En este método, aproximadamente del 1,1 al 1,7% del metano se quema para descomponer el hidrato de metano. Dado que el calor se genera en un recipiente, el metano producido no se mezcla con los gases de escape.
propiedades
Propiedades físicas
El hidrato de metano forma una masa de amarillo a gris, transparente a translúcida, que llena los espacios porosos del sedimento y forma depósitos coherentes. En condiciones normales, tiene una densidad de alrededor de 900 kilogramos por metro cúbico. En la naturaleza se presenta mezclado con material más pesado, como arena o roca, que contrarrestan su flotabilidad en el agua. El sedimento se cementa con efecto estabilizador. Debido al módulo de compresión del hidrato de metano, que es aproximadamente 4,5 veces mayor que el del agua , esta flotabilidad se mantiene en todas las profundidades del mar y aumenta ligeramente con la profundidad.
A una temperatura de 0 ° C, 1 metro cúbico de hidrato de metano contiene aproximadamente 164 metros cúbicos de metano. La concentración de metano en el hidrato de metano I es aproximadamente 5500 veces mayor que su solubilidad en agua líquida. Debido al alto contenido de metano, el hidrato de metano disociado se enciende en una llama abierta, la sustancia parece hielo ardiendo.
Hasta ahora, se han encontrado tres estructuras cristalinas de hidratos de metano: Tipo I con almacenamiento de metano y etano, así como con dióxido de carbono y dihidrosulfuro, Tipo II con propano e isobutano y Tipo H con hidrocarburos de cadena más larga como metilciclohexano. La zona de estabilidad del hidrato de metano puro comienza a una temperatura de alrededor de 5 ° C y una presión de 5 megapascales o 50 bar, correspondiente a una profundidad de agua de alrededor de 500 metros. Otros gases, como el sulfuro de hidrógeno , que forman hidratos mezclados con metano y dióxido de carbono , pueden disminuir el rango estable en aproximadamente 1 MPa a temperatura constante o aumentarlo en aproximadamente 2 ° C a presión constante.
La Estructura I tiene una estructura cúbica centrada en el cuerpo. La Estructura II, una estructura de diamante , se forma cuando el hidrato contiene metano y moléculas de gas termogénico que son más grandes que el etano y más pequeñas que el pentano . En la estructura H, el metano ocupa las jaulas pequeñas y también puede contener moléculas del tamaño de etilciclohexano .
| característica | helado | Hidrato de metano I. | Hidrato de metano II |
|---|---|---|---|
| Grupo espacial | P 6 3 / mmc (No. 194) | Pm 3 m (No. 221) | Fd 3 m (No. 227) |
| Número de moléculas de agua | Cuarto | 46 | 136 |
| Parámetros de celosía a 273 K. | a = 4,52 c = 7,36 | 12,0 | 17.3 |
A una presión de alrededor de 2500 bar , el hidrato de metano puro I se reordena en el hidrato de metano II y, a 6000 bar, en la forma H. Dado que estas presiones prevalecen en sedimentos profundos, estas formas podrían prevalecer allí en comparación con la forma convencional I.
Propiedades moleculares
Con la formación de 8 jaulas por 46 moléculas de agua en el hidrato de metano I, la relación molar de metano a agua cuando todas las jaulas están completamente ocupadas es 1: 5,75 mol de agua, la fórmula es por lo tanto CH 4 · 5,75 H 2 O. Al producirse el hidrato de metano, la ocupación de las jaulas, llamado número de hidratación, es menor y la relación molar es de aproximadamente 1: 6,0 a 1: 6,2 mol de agua. La masa ligada de metano en el hidrato de metano de origen natural es, por lo tanto, alrededor de un 4 a un 7% menos que en el caso ideal.
| Hidrato de metano | si | sII | sH | ||||
|---|---|---|---|---|---|---|---|
| Tamaño de la jaula | pequeña | estupendo | pequeña | estupendo | pequeña | medio | estupendo |
| descripción | 5 12 | 5 12 6 2 | 5 12 | 5 12 6 4 | 5 12 | 4 3 5 6 6 3 | 5 12 6 8 |
| Número de jaulas por celda unitaria | 2 | Sexto | dieciséis | Octavo | 3 | 2 | 1 |
| radio medio de la jaula en pm | 395 | 433 | 391 | 473 | 391 | 406 | 571 |
| Número de átomos de oxígeno por jaula | Vigésimo | 24 | Vigésimo | 28 | Vigésimo | Vigésimo | 36 |
La descomposición del hidrato de metano se investigó a nivel molecular por medio de 13 C de giro de ángulo mágico - espectroscopia de resonancia magnética nuclear . Se encontró que el tipo de ocupación de la jaula se mantuvo constante durante la disociación . Toda la celda unitaria se descompuso durante la disociación, ningún tipo de jaula de hidratos demostró ser más estable que otro.
La banda de estiramiento de CH del metano en la estructura I 5 12 6 2 jaulas ubicadas en el espectro Raman a un número de onda de 2904 cm -1 , en las 5 12 jaulas a 2916 cm -1 . La estructura del hidrato de metano se puede estimar utilizando las intensidades integrales de los picos de las diversas vibraciones de estiramiento de CH.
usar
materia prima
El uso de combustibles fósiles correspondió a unas 250 gigatoneladas de carbono entre 1880 y 1998. Las estimaciones de la proporción de depósitos de hidrato de metano que se pueden extraer y utilizar como combustible están plagadas de gran incertidumbre, pero incluso con estimaciones conservadoras, el hidrato de metano tiene un enorme potencial energético para el futuro.
Siempre que el metano pueda extraerse del hidrato de metano de forma segura, económica y respetuosa con el medio ambiente , las consecuencias para el suministro de energía y el impacto sobre el clima posiblemente sean de gran alcance. Debido a la alta relación molar de hidrógeno a carbono de 4: 1 en el metano, se suministra una mayor cantidad de energía por molécula de dióxido de carbono liberada cuando se quema metano que con cualquier otra fuente de energía que contenga carbono.
En el petróleo crudo, la relación molar aproximada de hidrógeno a carbono es alrededor de 2: 1 y en carbón alrededor de 1: 1. El poder calorífico del metano es más del doble que el del carbono puro . Por tanto, se prefiere el metano como fuente de energía sobre otros hidrocarburos.
Obstrucción de tuberías de gas natural.
Se pueden utilizar métodos químicos, hidráulicos, térmicos y mecánicos para suprimir la formación de hidrato de metano en las tuberías. Los aditivos como el etilenglicol o el metanol cambian la temperatura de equilibrio de la formación del hidrato de metano y así suprimen su formación. El metanol es un inhibidor de uso frecuente porque puede acumularse en trampas de vapor después de haber sido vaporizado previamente en el gas natural corriente arriba. Los dispersantes como los compuestos de amonio cuaternario suprimen la aglomeración del hidrato de metano. Los polímeros ralentizan el crecimiento de los cristales de hidrato de metano. Tanto los dispersantes como los polímeros suprimen la formación de hidrato de metano incluso en concentraciones bajas.
El método hidráulico de alivio de presión permite eliminar los cristales de hidrato de metano que ya se han formado en las tuberías. Con el método térmico, la tubería se calienta mediante calentamiento de trazas . Este método es especialmente adecuado para instrumentos como válvulas o puntos de muestreo .
La limpieza de tuberías es un método mecánico adecuado . Los cerdos se mueven a través de la tubería a través del flujo de producto y eliminan los depósitos de hidratos de metano. Los métodos se pueden combinar para aumentar la eficiencia. La eliminación de los bloqueos de las tuberías causados por la descomposición del hidrato de metano conlleva algunos riesgos. Al calentar desde el exterior, el tapón de hidratación se desprende de la pared de la tubería. La liberación de metano conduce a un fuerte aumento de volumen o presión. Estos pueden acelerar el tapón de hidrato de metano en la tubería; se han medido velocidades de hasta 300 km / h. Esto, a su vez, puede provocar un aumento de la presión en el gas natural que se transporta o la rotura de la tubería.
En el Trietilenglycoltrocknung se deshidrató el gas natural de trietileno mediante la absorción de agua en el mismo, reduciendo así el punto de rocío . Para hacer esto, el trietilenglicol desciende desde la parte superior de una columna en un proceso a contracorriente, deshidratando el gas natural húmedo y ascendente. El gas natural seco sale por la parte superior de la columna, mientras que el trietilenglicol se seca y se reutiliza. Como resultado del proceso de secado, el contenido de agua en el gas natural cae por debajo de la concentración límite necesaria para la formación de hidrato de metano.
Usar como almacenamiento
El gas natural se transporta y almacena convencionalmente como gas natural licuado o en forma comprimida. Esto requiere bajas temperaturas o altas presiones. Cuando se usa hidrato de metano, el metano puede almacenarse primero como hidrato de metano y liberarse de él si es necesario. Sin embargo, la formación de hidrato de metano puro todavía requiere presiones relativamente altas y bajas temperaturas. La reducción de la presión de formación de hidratos mediante la formación de hidratos mixtos, que además de metano contienen propano, tetrahidrofurano o promotores como el lauril sulfato de sodio , es un tema central de la investigación de hidratos. La liberación de metano se puede controlar regulando la temperatura del hidrato. El hidrato de metano es estable a una temperatura más alta que el gas natural licuado, pero el volumen requerido para el transporte es alrededor de 7,5 veces mayor. La pérdida de volumen de transporte en comparación con el gas natural licuado hace que una aplicación técnica sea bastante improbable.
Separación de gases
El metano como componente del gas de la mina puede enriquecerse mediante la formación de hidrato de metano y, por lo tanto, separarse del nitrógeno y el oxígeno. Por ejemplo, una mezcla de agua y tetrahidrofurano a temperaturas alrededor de 5 ° C y presiones entre 3 y 10 bar es adecuada para separar metano del gas de mina de baja concentración . Los tensioactivos como el lauril sulfato de sodio parecen aumentar el efecto de liberación.
Desalación de agua de mar
La idea de la desalinización del agua de mar con hidrato de metano y otros hidratos de gas se siguió desde el principio. En la década de 1960, Koppers desarrolló un proceso basado en propano . Otras variantes del proceso se basaron en el uso del refrigerante de 1,1-dicloro-1-fluoroetano (R-141b) o de dióxido de carbono . La separación de salmuera e hidratos requiere filtración.
Con hidrato de metano, sobre la base de la "desalinización basada en hidratos (HBS)", entre el 70 y el 95% de los cationes y entre el 73 y el 83% de los aniones podrían eliminarse del agua de mar. Si el hidrato de metano sólido se separa de la salmuera líquida, el agua dulce se recupera después de la disociación del hidrato y el metano puede volver a introducirse en el ciclo. Este es el proceso básico de desalinización basado en hidrato de metano. En comparación con los métodos establecidos, como la ósmosis inversa o la evaporación instantánea de múltiples etapas , la desalinización de agua de mar basada en hidratos juega un papel secundario.
Hidratar el almacenamiento en frío
Para la tecnología de almacenamiento en frío de hidratos, el metano se utiliza en combinación con otras sustancias como un refrigerante y dióxido de carbono. La implementación técnica aún se encuentra en etapa de desarrollo. El primer paso en el almacenamiento en frío de hidratos es bajar la temperatura al punto de formación de hidratos. Allí tiene lugar la formación de hidrato de metano exotérmico, que representa la parte principal del almacenamiento en frío. La energía fría almacenada se puede liberar a través de la disociación de hidratos endotérmicos al absorber el calor del medio ambiente. La elección de una mezcla de gases adecuada es de gran importancia para el almacenamiento en frío a base de hidratos. Debido a problemas de seguridad, especialmente con respecto a las fugas de gas, actualmente no se utilizan sistemas industriales basados en metano.
Importancia biológica
bacterias
Un examen de la abundancia de bacterias en los sedimentos profundamente hidratados de Blake Ridge y Cascadia Margin reveló bacterias tanto oxidantes como formadoras de metano. El metano, que se forma microbiológicamente en sedimentos más profundos, sube a la superficie y forma hidrato de metano allí. La zona de estabilidad de hidratos era un hábitat para las poblaciones oxidantes de metano, donde las tasas de oxidación de metano eran más altas. Allí se detectaron principalmente comunidades de proteobacterias . Estos utilizan la metano monooxigenasa que contiene hierro para la oxidación del metano a metanol. En la zona directamente debajo, la tasa de metanogénesis aumentó bruscamente. Los metanosarcinales y metanobacteriales se encontraron principalmente como generadores de metano .
Gusanos de hielo
En el norte del Golfo de México , el metano termogénico se escapa de los embalses subterráneos en mares fríos . El metano que se escapa forma en parte depósitos de hidrato de metano en el lecho marino. En julio de 1997, a una profundidad de más de 500 metros en el Golfo de México, se descubrió una población de cerdas de polietileno rosas, de aproximadamente 2 a 4 centímetros de largo, que viven de hidratos de metano. Los gusanos, también llamados "gusanos de hielo" o "gusanos de hielo de metano" ( Sirsoe methanicola ), pertenecen a la familia Hesionidae . Los gusanos de hielo excavan en el hidrato de metano, creando pequeñas depresiones. Los gusanos no solo colonizan el hidrato de metano expuesto, sino también el hidrato que está cubierto por sedimentos. La densidad de población es de alrededor de 2500 individuos por metro cuadrado.
El examen de isótopos del tejido de los gusanos de hielo indica una fuente de alimento quimioautotrófica . Estas son bacterias quimioautótrofas que viven libremente en el hidrato de metano y metabolizan el metano. Los gusanos suministran oxígeno a su hábitat y contribuyen así a la disolución del hidrato de metano.
Mejillones Bathymodiolus

Además de los gusanos de hielo, los mejillones Bathymodiolus childressi se encuentran en los depósitos de hidrato de metano . Estos albergan simbiontes quimioautótrofos bacterianos en las branquias que se alimentan del metano que se absorbe del agua de mar. La relación de isótopos de carbono δ13C de -51 a -57 ‰ que se encuentra en los animales apoya la suposición de que el metano es la principal fuente de carbono tanto para el mejillón como para los simbiontes.
Gusanos de tubo
Montículos más grandes de gusanos tubícolas del género Vestimentiferans fueron colonizados por depósitos de hidrato de metano . Su dieta principal proviene de los fluidos ricos en sulfuro metabolizados por el sulfuro de hidrógeno simbiótico o bacterias oxidantes de metano que viven en un órgano interno llamado trofosoma . Cuando el gusano muere, las bacterias se liberan y regresan a la población de vida libre en el agua de mar.
Relevancia climática
El metano absorbe la radiación infrarroja emitida por la tierra con más fuerza que el dióxido de carbono, que se juzga por su potencial de calentamiento global en relación con el dióxido de carbono; para un horizonte de tiempo de 100 años, el valor es 28. En la atmósfera, el metano es oxidado por radicales hidroxilo a través de etapas intermedias como formaldehído a dióxido de carbono y agua. Se estima que la vida media atmosférica es de 12 años.
Paleoclima

La variación en la concentración de metano atmosférico tiene una alta probabilidad de influir en la temperatura de la superficie de la tierra en el curso de la historia de la tierra. Las concentraciones de metano de 1000 partes por millón o superior se dice que han compensado la menor salida de radiación de la joven dom débil en el pasado distante. Se cree que explican las temperaturas de la superficie por encima del punto de congelación en ese momento. Se dice que la oxidación del metano atmosférico durante la gran catástrofe del oxígeno , el aumento de la concentración de oxígeno molecular y la disminución asociada de la concentración de metano en la atmósfera hace unos 2.400 millones de años, y la consiguiente falta de efecto invernadero, son responsables de la glaciación paleoproterozoica .
La disolución del hidrato de metano como fuente de metano atmosférico se ha discutido como una explicación de varios eventos paleoclimáticos. La disminución de la formación de hielo global en la Tierra Bola de Nieve a finales del Precámbrico se atribuye a la disolución del hidrato de metano en el permafrost ecuatorial . Sin embargo, la hipótesis de la congelación total de la tierra es científicamente controvertida.
Una fuerte liberación de metano parece haber ocurrido hace 55 millones de años durante el máximo de temperatura del Paleoceno / Eoceno y el Máximo Térmico del Eoceno 2 . En ese momento hubo un calentamiento global de la atmósfera. La evidencia de un rápido aumento en el contenido de metano del aire ahora se puede encontrar en las rocas de esa época. Sin embargo, el patrón de cambios de isótopos esperados como resultado de una liberación masiva de metano del hidrato de metano no concuerda con los patrones observados. La relación de isótopos de deuterio a hidrógeno sugiere que el metano se liberó en los humedales. La investigación de los núcleos de hielo de Groenlandia no encontró evidencia de que las emisiones masivas de metano, que podrían estar asociadas con la desintegración a gran escala del hidrato de metano, desencadenaran o intensificaran períodos cálidos como el Alleröd Interstadial .
En el curso del calentamiento global, una liberación crónica de metano durante siglos puede conducir a altas concentraciones de metano en la atmósfera, a una retroalimentación intensificada , ya que el metano intensifica el efecto invernadero . El derretimiento del hielo continental, cuyo agua hace que el nivel del mar suba y, por lo tanto, aumenta la presión sobre el fondo marino, solo puede estabilizar los depósitos de hidratos de forma limitada. No está claro si realmente puede entrar suficiente metano a la atmósfera en caso de descomposición para desencadenar el cambio climático. Una indicación de ello son las distribuciones de isótopos de carbono en marinos carbonatos de la Paleocene .
Potencial de calentamiento global
La descomposición de los hidratos de metano solo hizo una pequeña contribución al equilibrio de metano de la atmósfera con alrededor de 6 millones de toneladas de metano liberadas en 2017. Las emisiones de metano de los humedales y la agricultura, por otro lado, liberaron cada una más de 200 millones de toneladas de metano. Sin embargo, el calentamiento de los océanos y la atmósfera reduce el campo de estabilidad del hidrato de metano y conduce a una liberación del metano unido en el hidrato de metano a los sedimentos y suelos suprayacentes. El metano libre puede escapar de forma difusa o como un gas que asciende desde el fondo del mar al agua del océano. Los trozos de hidrato de metano separados sin adhesión de sedimentos son más livianos que el agua, se elevan y se desintegran parcialmente en su camino hacia arriba y transportan el metano rápidamente a capas de agua más altas. Este tipo de transporte es raro y apenas contribuye a la liberación de metano.
Factores como el metabolismo microbiológico del metano también reducen los efectos de la disociación del hidrato de metano sobre la concentración de metano atmosférico. El metano se puede descomponer de dos maneras en su camino hacia la superficie del mar. Por un lado, el metano sigue atravesando una zona de oxidación anaeróbica del metano en el fondo del mar , en la que se produce la oxidación por sulfatos según la siguiente ecuación de reacción:
El hidrogenocarbonato resultante precipita como carbonato de calcio y, por tanto, forma un sumidero importante para el metano liberado del hidrato de metano. En la zona aeróbica de arriba , se oxida bacterianamente por el oxígeno disuelto allí, liberando dióxido de carbono. El dióxido de carbono formado reduce el valor del pH y contribuye así a la acidificación de los mares . La influencia de los depósitos marinos de aguas profundas en el balance de metano atmosférico es insignificante y se clasifica como baja a largo plazo. El calentamiento de las capas de aguas profundas, que es causado por la descomposición del hidrato de metano por las temperaturas atmosféricas más altas, avanza muy lentamente, ya que la capacidad de almacenamiento de calor del agua en los tres metros superiores del océano corresponde a la capacidad de almacenamiento de calor de toda la superficie. atmósfera.
Los depósitos de hidrato de metano marino en las proximidades del campo de estabilidad marina y en suelos de permafrost terrestres e inundados en las regiones árticas continentales podrían tener un mayor impacto en el clima . En el Océano Ártico , debido a la baja temperatura, se esperan depósitos de hidrato de metano en el sedimento desde una profundidad de agua de alrededor de 300 metros. El metano es menos soluble en agua a menor profundidad del mar debido a la menor presión allí, puede elevarse en burbujas y llegar a la atmósfera.
El calentamiento de los suelos de permafrost puede liberar metano tan pronto como el suelo se descongele. Un estudio de 2016 estimó que la contribución del metano liberado por el permafrost al calentamiento global es "todavía relativamente baja". En 2020, se encontró evidencia frente a la costa este de Siberia de que el metano podría liberarse de los hidratos de metano en el Océano Ártico sobre un área del talud continental. Si el metano llega a la atmósfera desde estos sedimentos y suelos, podría tener un efecto de retroalimentación positiva sobre el cambio climático actual y provocar una aceleración del calentamiento global.
Geopeligros
Tobogán Storegga

En el borde de la plataforma continental noruega en el Mar de Noruega, se produjeron deslizamientos de tierra submarinos hacia el final de las últimas glaciaciones. Los tres toboganes conocidos de Storegga se encuentran entre los toboganes más grandes conocidos. El último deslizamiento de tierra con un volumen de 3500 kilómetros cúbicos de escombros ocurrió hace unos 8200 años y provocó un megatsunami en el Atlántico norte .
Se consideró que la disolución del hidrato de metano a una profundidad de alrededor de 170 a 260 metros por debajo del talud continental fue el desencadenante de los deslizamientos de tierra. Se dice que el agua caliente entrante desplazó la zona de estabilidad del hidrato de metano y compensó en exceso el efecto de presión del aumento del nivel del mar a través del retroceso de la capa de hielo.
Otras teorías sugieren que las corrientes de agua del derretimiento de los glaciares llevaron billones de toneladas de sedimentos al océano. Esto se acumuló en el borde de la plataforma continental, donde el fondo marino menos profundo alrededor de Escandinavia cae a las profundidades del Mar de Noruega. Un terremoto en un área a 150 kilómetros cuesta abajo desde el campo de gas de Ormen-Lange hizo que los depósitos submarinos fueran inestables y provocó el deslizamiento de tierra.
Deslizamientos de tierra de Cape Fear
Los datos sísmicos sugieren que en Cape Fear cerca de Wilmington , Carolina del Norte , se han producido al menos cinco importantes deslizamientos de tierra submarinos en los últimos 30.000 años. Después de que se encontraron ocurrencias de hidrato de metano allí, se discutió que la disolución de los depósitos de hidrato de metano desencadenó los deslizamientos de tierra. Aunque el mecanismo exacto de activación de los eventos de deslizamiento de Cape Fear es poco conocido, estudios más recientes indican que al menos cuatro de cada cinco eventos de deslizamiento ocurrieron muy por encima de los depósitos de hidrato de metano.
Tectónica de desgasificación de metano
Hay una serie de superficies rocosas deformadas y cuevas graníticas cerca de Hudiksvall en Suecia . El área probablemente fue golpeada por un poderoso terremoto en tiempos prehistóricos. El área de la Cueva de Boda local está deformada y cortada en bloques. La distancia de la Cueva Boda desde el epicentro del terremoto en ese momento es de unos 12 kilómetros. Se cree que la deformación encontrada allí fue causada por una caída explosiva de hidrato de metano provocada por la onda de choque sísmica del terremoto.
Influencia en el envío
La desintegración de grandes cantidades de hidrato de metano y las burbujas de metano que se elevan de él se han culpado repetidamente por el hundimiento de barcos en el Triángulo de las Bermudas . El principio de Arquímedes establece que la flotabilidad estática de un cuerpo en un medio es tan grande como el peso del medio desplazado por el cuerpo. El aumento de las burbujas de gas metano a reducir la densidad de la agua de mar . Esta disminución reduce la fuerza de flotabilidad sobre el objeto flotante, lo que puede provocar que se hunda. Del mismo modo, las grandes burbujas de metano individuales podrían hundir barcos.
La energía para la descomposición del hidrato de metano requiere un alto aporte de calor o una caída de presión significativa. Hay indicios de que la degradación del hidrato de metano por reducción de la presión tuvo lugar en relación con las edades de hielo . A medida que el agua de mar se unió a las grandes capas de hielo continentales , el nivel del mar descendió. Esto redujo la presión sobre el hidrato de metano, lo que resultó en una liberación de metano. Sin embargo, este mecanismo es lento y la liberación se produce durante un largo período de tiempo. En el caso de los depósitos de hidrato de metano que están cerca del límite de la zona de estabilidad del hidrato de metano, hay indicios de que los cambios de presión debidos al rango de las mareas pueden liberar metano. Además del hecho de que no se hundió un número inusual de barcos en el Triángulo de las Bermudas, las posibilidades de una liberación espontánea de gas del hidrato de metano que se han considerado hasta ahora no se aplican al Triángulo de las Bermudas.
prueba

La detección de hidrato de metano en los márgenes continentales se realiza principalmente mediante métodos sísmicos . La estructura del subsuelo se examina utilizando señales acústicas reflejadas. Pulsadores de aire se utilizan como fuente de sonido, y las ondas sonoras reflejadas son recogidos por los hidrófonos .
La resistencia a las ondas acústicas es mayor en el sedimento debajo del fondo del mar que en la columna de agua de arriba . El sonido se refleja fuertemente en la interfaz entre dos sustancias con una gran diferencia en la resistencia a las ondas. La señal de un fondo marino libre de hidratos de metano se caracteriza por un tipo especial de reflexión en la que el volumen subterráneo es más duro que el volumen de arriba.
En el caso de las capas que contienen hidrato de metano, el reflector que simula el suelo se caracteriza por un tipo diferente de reflexión, lo que indica una alta resistencia a las olas en el hidrato de metano sobre sedimentos llenos de gas metano con una baja resistencia a las olas. Explorar la ubicación de las áreas de hidrato de metano utilizando métodos sísmicos es relativamente fácil en áreas donde el reflector que simula el suelo es fácilmente reconocible. El reflector que simula el suelo generalmente marca la base de una capa de hidrato de metano debajo de la cual hay gas libre. Sin embargo, la determinación de la proporción exacta de hidrato de metano en el sedimento solo por métodos sísmicos es difícil y posiblemente imprecisa. En áreas sin gas libre por debajo del hidrato de metano, no hay reflector simulador de suelo; la detección de hidrato de metano allí requiere otros métodos, como la extracción de núcleos de perforación.
En la investigación espacial, el uso de espectroscopía infrarroja podría ser una forma de detectar el hidrato de metano. Las moléculas de metano encerradas muestran un comportamiento gaseoso a bajas temperaturas de 10 a 200 Kelvin en el rango infrarrojo cercano a medio en las jaulas de agua, cuyos espectros de vibración son únicos para el hidrato de metano.
enlaces web
literatura
- E. Dendy Sloan Jr., Carolyn A. Koh: Hidratos de clatrato de gases naturales. CRC Press, 2008, Boca Raton, ISBN 978-0-8493-9078-4 , 730 páginas.
- Yuri F. Makogon: Hidratos de Hidrocarburos. Penn Well Publishing Company, Tulsa, 1997, ISBN 0-87814-718-7 , 482 páginas.
Evidencia individual
- ^ Entrada sobre clatratos . En: Compendio de terminología química de la IUPAC (el “Libro de oro”) . doi : 10.1351 / goldbook.C01097 Versión: 3.0.1.
- ↑ Entrada sobre el compuesto de inclusión . En: Compendio de terminología química de la IUPAC (el “Libro de oro”) . doi : 10.1351 / goldbook.I02998 Versión: 3.0.1.
- ↑ Erich Rummich: Almacenamiento de energía. Conceptos básicos, componentes, sistemas y aplicaciones. Experto Verlag, Renningen, 2009, ISBN 978-3-8169-2736-5 , págs. 56-59.
- ^ A b Keith C. Hester, Peter G. Brewer: Hidratos de clatrato en la naturaleza. En: Annual Review of Marine Science . 1, 2009, págs. 303-327, doi: 10.1146 / annurev.marine.010908.163824 .
- ↑ Marco Lauricella et al.: Mecanismo de nucleación de hidrato de clatrato de metano mediante simulaciones moleculares avanzadas. En: Revista de Química Física . C 118.40, 2014, págs. 22847-22857.
- ↑ Hailong Lu et al.: Hidrato de gas complejo del margen de Cascadia. En: Naturaleza . 445, 2007, págs. 303-306, doi: 10.1038 / nature05463 .
- ↑ E. Dendy Sloan Jr., Carolyn A. Koh: Hidratos de clatrato de gases naturales. CRC Press, 2008, Boca Raton, ISBN 978-0-8493-9078-4 , págs. 1-2.
- ↑ a b Yuri F. Makogon: hidrato de hidrocarburos. Penn Well Publishing Company, Tulsa, 1997, ISBN 0-87814-718-7 , págs. 1-3.
- ^ A b c S. V. Goshovskyi, Oleksii Zurian: Hidratos de gas - Historia del descubrimiento. En: Мінеральні ресурси України . 2019, págs. 45–49, doi: 10.31996 / mru.2019.1.45-49 .
- ↑ Yu A. Dyadin et al.: Medio siglo de historia de la química del clatrato. En: Revista de Química Estructural . 40.5, 1999, págs. 645-653.
- ^ EG Hammerschmidt: Formación de hidratos de gas en líneas de transmisión de gas natural. En: Química Industrial e Ingeniería . 26, 1934, págs. 851-855, doi: 10.1021 / ie50296a010 .
- ^ M. von Stackelberg: hidratos de gas sólido. En: Ciencias Naturales . 36, 1949, págs. 327-333, doi: 10.1007 / BF00596788 .
- ↑ M. v. Stackelberg, HR Müller: Hidratos de gas sólido II Estructura y química espacial. En: Zeitschrift für Elektrochemie, informes de la Sociedad Bunsen de química física . 1954, págs. 25-39, doi: 10.1002 / bbpc.19540580105 .
- ↑ M. v. Stackelberg, W. Meinhold: Hidratos de gas sólido III. Hidratos mixtos. En: Zeitschrift für Elektrochemie, informes de la Sociedad Bunsen de química física. 1954, págs. 40-45, doi: 10.1002 / bbpc.19540580106 .
- ↑ JC Platteeuw, JH van der Waals: Propiedades termodinámicas de los hidratos de gas. En: Física Molecular . 1, 2010, págs. 91-96, doi: 10.1080 / 00268975800100111 .
- ^ E. Dendy Sloan Jr., Carolyn A. Koh: Hidratos de clatrato de gases naturales. CRC Press, Boca Raton, Londres, Nueva York, ISBN 978-0-8493-9078-4 , p. 23.
- ↑ Timothy Collett et al.: Revisión histórica del proyecto de hidrato de metano. Consortium for Ocean Leadership, 2013. Número de proyecto: DE - FE0010195, p. 1.
- ↑ a b c d Y. C. Beaudoin, W. Waite, R. Boswell, SR Dallimore (Eds.): Calor congelado: Una perspectiva mundial del PNUMA sobre los hidratos de gas metano. Volumen 1. Programa de las Naciones Unidas para el Medio Ambiente, 2014, ISBN 978-92-807-3429-4 , pág.7 .
- ↑ Gerald R. Dickens, Charles K. Paull, Paul Wallace: Medición directa de cantidades de metano in situ en un gran depósito de hidratos de gas. En: Naturaleza . 385, 1997, págs. 426-428, doi: 10.1038 / 385426a0 .
- ↑ Gerald R. Dickens, James R. O'Neil, David K. Rea, Robert M. Owen: disociación del hidrato de metano oceánico como causa de la excursión de isótopos de carbono al final del Paleoceno. En: Paleoceanografía . 10, 1995, págs. 965-971, doi: 10.1029 / 95PA02087 .
- ↑ Masanori Kurihara et al.: Análisis de datos de producción para las pruebas de producción de hidratos de gas Mallik 2007/2008 en Canadá. Trabajo presentado en la Conferencia y Exposición Internacional de Petróleo y Gas en China, Beijing, China, junio de 2010. Número de artículo: SPE-132155-MS, doi: 10.2118 / 132155-MS .
- ^ Shari A. Yvon-Lewis, Lei Hu, John Kessler: Flujo de metano a la atmósfera desde el desastre petrolero de Deepwater Horizon. En: Cartas de investigación geofísica . 38, 2011, S. y L01602, doi: 10.1029 / 2010GL045928 .
- ↑ Peter Folger: Hidratos de gas: recurso y peligro. Servicio de Investigación del Congreso, 2010, 7-5700, RS22990, p. 5.
- ↑ Juwon Lee, John W. Kenney III.: Hidratos de clatrato. En: Solidificación . 2018, pág.129 , doi: 10.5772 / intechopen.72956 .
- ↑ Joel Parshall: El método de producción de hidrato de metano tiene éxito científico. En: Journal of Petroleum Technology . 64.08, 2012, págs. 50-51.
- ↑ Yoshihiro Tsuji et al.: Descripción general de los pozos MITI Nankai Trough: un hito en la evaluación de los recursos de hidrato de metano. En: Geología de recursos . 54.1, 2004, págs. 3-10.
- ↑ K. Yamamoto, X.-X. Wang, M. Tamaki, K. Suzuki: La segunda producción en alta mar de hidrato de metano en el canal Nankai y el comportamiento de la producción de gas a partir de un yacimiento heterogéneo de hidrato de metano. En: RSC Advances . 9, 2019, págs. 25987-26013, doi: 10.1039 / C9RA00755E .
- ↑ Laboratorio Nacional de Tecnología Energética: Programa de I + D de hidratos de metano NETL: Aspectos destacados del programa 2000-2020. Enero de 2020, págs. 24-25.
- ↑ a b Hans Carsten Runge: Hidratos de metano: ¿un suministro útil de gas natural “no convencional”? Biblioteca Central, Forschungszentrum Jülich, Informes especiales núm. 577, julio de 1990, ISSN 0343-7639, págs. 1-6.
- ↑ a b c d Judith Schicks: Metano en el hidrato de gas. Atrapado en una jaula de agua. En: Química en nuestro tiempo . 42, 2008, págs. 310-320, doi: 10.1002 / ciuz.200800457 .
- ↑ a b c d e K. Tú, PB Flemings, A. Malinverno, TS Collett, K. Darnell: Mecanismos de formación de hidrato de metano en sistemas geológicos. En: Reseñas de geofísica . 57, 2019, págs. 1146-1231, doi: 10.1029 / 2018RG000638 .
- ↑ Alexei V. Milkov: Estimaciones globales de gas ligado a hidratos en sedimentos marinos: ¿cuánto hay realmente?. En: Earth-Science Reviews . 66, 2004, págs. 183-197, doi: 10.1016 / j.earscirev.2003.11.002 .
- ^ YC Beaudoin, W. Waite, R. Boswell, SR Dallimore (Eds.): Calor congelado: Una perspectiva mundial del PNUMA sobre los hidratos de gas metano. Volumen 2. Programa de las Naciones Unidas para el Medio Ambiente, 2014, ISBN 978-92-807-3319-8 , p. 39.
- ↑ Diagrama de flujo de energía de la República Federal de Alemania 2019. Detalle en Petajoule (PJ). En: datos y hechos. AG Energiebilanzen, 28 de mayo de 2021, consultado el 29 de agosto de 2021 .
- ↑ Judith Maria Schicks, Manja Luzi-Helbing, Erik Spangenberg: Recurso incluido: metano en hidratos de gas natural. En: Sistema Tierra . 1.2, 2011, págs. 52-59, doi: 10.2312 / GFZ.syserde.01.02.5 .
- ↑ a b c d e f g Carolyn D. Ruppel, John D. Kessler: La interacción del cambio climático y los hidratos de metano. En: Reseñas de geofísica . 55, 2017, págs. 126–168, doi: 10.1002 / 2016RG000534 .
- ↑ M. Riedel, TS Collett, P. Kumar, AV Sathec, A. Cook: Imágenes sísmicas de un sistema de hidrato de gas fracturado en la cuenca de Krishnae-Godavari en la costa de la India. En: Geología Marina y del Petróleo . 27, 2010, págs. 1476-1493, doi: 10.1016 / j.marpetgeo.2010.06.002 .
- ↑ Gerhard Bohrmann, Jens Greinert, Erwin Suess, Marta Torres: Carbonatos autigénicos de la zona de subducción de Cascadia y su relación con la estabilidad de los hidratos de gas. En: Geología . 26, 1998, págs.647-650, doi : 10.1130 / 0091-7613 (1998) 026 <0647: ACFTCS> 2.3.CO; 2 .
- ^ Arthur H. Johnson: potencial de recursos globales de hidrato de gas: un nuevo cálculo. En: Nat. Gasóleo . 304, 2011, págs. 285-309.
- ↑ MI Kuzmin, GV Kalmychkov, VA Geletiy et al.: El primer descubrimiento de los hidratos de gas en los sedimentos del lago Baikal. En: Anales de la Academia de Ciencias de Nueva York . 912, 2000, pág.112, doi: 10.1111 / j.1749-6632.2000.tb06764.x .
- ↑ Oleg Khlystov et al: Hidrato de gas del lago Baikal: Descubrimiento y variedades. En: Revista de Ciencias de la Tierra de Asia . 62, 2013, págs. 162-166, doi: 10.1016 / j.jseaes.2012.03.009 .
- ↑ a b Timothy S. Collett: Evaluación de los recursos de hidratos de gas en North Slope, Alaska, 2008. En: AGU Fall Meeting Abstracts . Hoja informativa 2008–3073O, 2008, 4 páginas.
- ↑ D. Qasim, G. Fedoseev, K.-J. Chuang, J. He, S. Ioppolo, EF van Dishoeck, H. Linnartz: Un estudio experimental de la formación superficial de metano en nubes moleculares interestelares. En: Nature Astronomy . 4, 2020, págs. 781-785, doi: 10.1038 / s41550-020-1054-y .
- ↑ a b Olivier Mousis et al .: Clatratos de metano en el sistema solar En: Astrobiología . 15.4, 2015, págs. 308–326.
- ↑ JD Anderson et al .: Radiociencia con Voyager 2 en Urano: Resultados sobre masas y densidades del planeta y cinco satélites principales. En: Revista de Investigación Geofísica: Física espacial . 92.A13, 1987, págs. 14877-14883.
- ↑ Shunichi Kamata et al.: El océano de Plutón está cubierto y aislado por hidratos de gas. En: Nature Geoscience . 12.6, 2019, S: 407-410, doi: 10.1038 / s41561-019-0369-8 .
- ^ Roger R. Fu et al.: La estructura interior de Ceres revelada por la topografía de la superficie. En: Letras de Ciencias Planetarias y de la Tierra . 476, 2017, págs.153-164, doi: 10.1016 / j.epsl.2017.07.053 .
- ↑ Posibles fuentes y sumideros de metano en Mars.Nava.gov, consultado el 1 de marzo de 2021
- ↑ Olivier Mousis et al .: Atrapamiento volátil en clatratos marcianos. En: Space Science Reviews . 174.1-4, 2013, págs. 213-250, doi: 10.1007 / s11214-012-9942-9 .
- ^ SR Gainey, ME Elwood Madden: Cinética de la formación y disociación del clatrato de metano en las condiciones relevantes de Marte. En: Ícaro . 218, 2012, págs. 513-524, doi: 10.1016 / j.icarus.2011.12.019 .
- ↑ Caroline Thomas et al.: Variabilidad del atrapamiento de metano en hidratos de clatrato del subsuelo marciano. En: Ciencia planetaria y espacial . 57.1, 2009, págs. 42-47, doi: 10.1016 / j.pss.2008.10.003 .
- ↑ Layers of Titan (consultado el 1 de marzo de 2021).
- ↑ GF Lindal, GE Wood, HB Hotz, DN Sweetnam, VR Eshleman, GL Tyler: La atmósfera de Titán: Un análisis de las medidas de ocultación de radio de la Voyager 1. En: Ícaro . 53, 1983, págs. 348-363, doi: 10.1016 / 0019-1035 (83) 90155-0 .
- ↑ Nicholas A. Lombardo et al.: Etano en la estratosfera de Titán de CIRS espectros de infrarrojo medio y lejano. En: The Astronomical Journal . 157, 2019, págs. 160-170, doi: 10.3847 / 1538-3881 / ab0e07 .
- ↑ Jonathan I. Lunine, Sushil K. Atreya: El ciclo del metano en Titán. En: Nature Geoscience . 1, 2008, págs. 159-164, doi: 10.1038 / ngeo125 .
- ↑ Ralph Pudritz, Paul Higgs, Jonathon Stone: Sistemas planetarios y el origen de la vida. Cambridge Ambridge University Press, Cambridge, Nueva York, Melbourne, Madrid, Ciudad del Cabo, Singapur, São Paulo, ISBN 978-0-521-87548-6 , p. 280.
- ↑ a b Alexis Bouquet, Olivier Mousis, J. Hunter Waite, Sylvain Picaud: posible evidencia de una fuente de metano en el océano de Encelado. En: Cartas de investigación geofísica . 42, 2015, págs. 1334-1339, doi: 0.1002 / 2014GL063013 .
- ↑ Keith A. Kvenvolden: Una revisión de la geoquímica del metano en el hidrato de gas natural. En: Geoquímica orgánica . 23.11-12, 1995, págs. 997-1008.
- ↑ Yuri F. Makogon: hidrato de hidrocarburos. Pennwell Publishing Company, Oklahoma, 1997, ISBN 0-87814-718-7 , p. 340.
- ↑ Ross Chapman et al.: Hidratos de gas termogénico en el margen norte de Cascadia. En: Eos, Transactions American Geophysical Union . 85.38, 2004, págs. 361-365.
- ↑ Laboratorio Nacional de Tecnología Energética: Ciencia y Tecnología de Methanehydrate: A 2017 Update. Departamento de Energía de EE. UU., Julio de 2017, p. 5.
- ↑ Maninder Khurana, Zhenyuan Yin, Praveen Linga: Una revisión de la nucleación de hidratos de clatrato. En: Química e Ingeniería Sostenible ACS . 5, 2017, págs. 11176-11203, doi: 10.1021 / acssuschemeng.7b03238 .
- ↑ a b c Y. C. Beaudoin, W. Waite, R. Boswell, SR Dallimore (Eds.): Calor congelado: Una perspectiva mundial del PNUMA sobre los hidratos de gas metano. Volumen 2. Programa de las Naciones Unidas para el Medio Ambiente, 2014, ISBN 978-92-807-3319-8 , p. 60.
- ↑ George J. Moridis, Timothy S. Collett, Scott R. Dallimore, Tohru Satoh, Steven Hancock, Brian Weatherill: Estudios numéricos de la producción de gas de varias zonas de hidrato de CH4 en el sitio de Mallik, Delta del Mackenzie, Canadá. En: Revista de Ciencias e Ingeniería del Petróleo . 43, 2004, págs. 219-238, doi: 10.1016 / j.petrol.2004.02.015 .
- ↑ a b c Klaus Wallmann et al.: Uso comercial futuro de los depósitos de hidrato de metano en el fondo del mar. En: Wissenschaftliche Auswertungen 2011, págs. 285–288.
- ^ Yongchen Song et al.: Evaluación de la producción de gas a partir de hidratos de metano mediante despresurización, estimulación térmica y métodos combinados. En: Energía aplicada . 145, 2015, págs. 265-277, doi: 10.1016 / j.apenergy.2015.02.040 .
- ↑ Solomon Aforkoghene Aromada, Bjørn Kvamme, n.a. Wei, Navid Saeidi: Entalpías de formación y disociación de hidratos de la termodinámica residual. En: Energías . 12, 2019, pág.4726, doi: 10.3390 / en12244726 .
- ↑ Huen Lee, Yongwon Seo, Yu-Taek Seo, Igor L. Moudrakovski, John A. Ripmeester: Recuperación de metano de hidrato de metano sólido con dióxido de carbono. En: Angewandte Chemie . 115, 2003, págs. 5202-5205, doi: 10.1002 / anie.200351489 .
- ↑ JH Sira, SL Patil, VA Kamath: Estudio de la disociación de hidratos por inyección de metanol y glicol. Conferencia y exposición técnica anual de la SPE, Nueva Orleans, Luisiana, septiembre de 1990. Número de artículo: SPE-20770-MS, doi: 10.2118 / 20770-MS .
- ↑ Ayhan Demirbas: Hidratos de metano como recurso energético potencial: Parte 2 - Procesos de producción de metano a partir de hidratos de gas. En: Conversión y Gestión de Energía . 51.7, 2010, págs. 1562-1571, doi: 10.1016 / j.enconman.2010.02.014
- ↑ a b c Aliakbar Hassanpouryouzband et al.: Hidratos de gas en química sostenible. En: Reseñas de la Sociedad Química . 49.15, 2020, págs. 5225-5309, doi: 10.1039 / c8cs00989a .
- ↑ Constantin Cranganu: Estimulación térmica in situ de hidratos de gas. En: Revista de Ciencias e Ingeniería del Petróleo . 65, 2009, págs. 76-80, doi: 10.1016 / j.petrol.2008.12.028 .
- ^ A b c d E. Dendy Sloan: Hidratos de gas: Revisión de las propiedades físicas y químicas. En: Energía y combustibles . 12, 1998, págs. 191-196, doi: 10.1021 / ef970164 + .
- ↑ S. Alireza Bagherzadeh, Saman Alavi, John A. Ripmeester, Peter Englezos: Evolución del metano durante la disociación de hidratos de gas. En: Equilibrios de fase fluida . 358, 2013, págs. 114-120, doi: 10.1016 / j.fluid.2013.08.017 .
- ↑ IM. Chou, A. Sharma, RC Burruss, J. Shu, H.-k. Mao, RJ Hemley, AF Goncharov, LA Stern, SH Kirby: Transformaciones en hidratos de metano. En: Actas de la Academia Nacional de Ciencias . 97, 2000, págs. 13484-13487, doi: 10.1073 / pnas.250466497 .
- ↑ CD Ruppel, WF Waite: Gran desafío: escalas de tiempo y procesos de formación y descomposición del hidrato de metano, con aplicación a sistemas geológicos. En: Revista de Investigación Geofísica : Tierra sólida. 125, 2020, doi: 10.1029 / 2018JB016459 .
- ^ Arvind Gupta, Steven F. Dec, Carolyn A. Koh, ED Sloan: Investigación de RMN de la disociación del hidrato de metano. En: The Journal of Physical Chemistry C. 111, 2007, págs. 2341-2346, doi: 10.1021 / jp066536 + .
- ↑ Erwin Suess, Gerhard Bohrmann: Hielo ardiente: ocurrencia, dinámica e influencias ambientales de los hidratos de gas. En: Marum , Universidad de Bremen, 2010. págs. 234–243.
- ↑ a b Rudolph Hopp: Fundamentos de la tecnología química: para la práctica y la formación profesional. Wiley-VCH, Weinheim, 2001, ISBN 3-527-29998-X , pág.452.
- ↑ a b c Imen Chatti, Anthony Delahaye, Laurence Fournaison, Jean-Pierre Petitet: Beneficios e inconvenientes de los hidratos de clatrato: una revisión de sus áreas de interés. En: Conversión y Gestión de Energía . 46, 2005, págs. 1333-1343, doi: 10.1016 / j.enconman.2004.06.032 .
- ↑ E. Dendy Sloan Jr., Carolyn A. Koh: Hidratos de clatrato de gases naturales. CRC Press, 2008, Boca Raton, ISBN 978-0-8493-9078-4 , págs. 9-11.
- ^ E. Dendy Sloan: Principios fundamentales y aplicaciones de los hidratos de gas natural. En: Naturaleza . 426, 2003, págs. 353-359, doi: 10.1038 / nature02135 .
- ↑ CIC Anyadiegwu, Anthony Kerunwa, Patrick Oviawele: Deshidratación de gas natural con trietilenglicol (TEG). En: Petroleum & Coal , 56, 4, 2014, págs. 407-417.
- ↑ Pezhman Kazemi, Roya Hamidi: Análisis de sensibilidad de una planta de deshidratación de trietilenglicol de gas natural en la región del Golfo Pérsico. En: Petroleum & Coal , 53, 1, 2011, págs. 71-77, ISSN 1337-7027.
- ↑ Hongjun Yang, Shuanshi Fan, Xuemei Lang, Yanhong Wang: Equilibrios de fase de hidratos de gas mixto de oxígeno + tetrahidrofurano, nitrógeno + tetrahidrofurano y aire + tetrahidrofurano. En: Journal of Chemical & Engineering Data . 56, 2011, págs. 4152-4156, doi: 10.1021 / je200676k .
- ↑ Jianzhong Zhao, Yangsheng Zhao, Weiguo Liang: Separación de gas a base de hidratos para la recuperación de metano del gas de la mina de carbón usando tetrahidrofurano. En: Tecnología Energética . 4, 2016, págs. 864–869, doi: 10.1002 / ente.201600047 .
- ↑ Xiao-Sen Li, Jing Cai, Zhao-Yang Chen, Chun-Gang Xu: Separación de metano a base de hidratos del metano de lecho de carbón de drenaje con solución de tetrahidrofurano en presencia de dodecilsulfato de sodio. En: Energía y combustibles . 26, 2012, págs. 1144-1151, doi: 10.1021 / ef201804d .
- ↑ Kyung Chan Kang, Praveen Linga, Kyeong-nam Park, Sang-June Choi, Ju Dong Lee: Desalinización de agua de mar mediante proceso de hidrato de gas y características de eliminación de iones disueltos (Na + , K + , Mg 2+ , Ca 2+ , B 3+ , Cl - , SO 4 2- ). En: Desalación . 353, 2014, págs. 84-90, doi: 10.1016 / j.desal.2014.09.007 .
- ↑ Sabine Lattemann y otros: Situación global de la desalación. En: Ciencia e Ingeniería de la Sostenibilidad . 2, 2010, págs. 7-39.
- ↑ David W. Reed et al.: Comunidades microbianas de sedimentos marinos profundos que contienen hidratos de metano en una cuenca de Forearc. En: Microbiología aplicada y ambiental . 68.8, 2002, págs. 3759-3770, doi: 10.1128 / AEM.68.8.3759-3770.2002 .
- ↑ Harold Basch et al.: Mecanismo de la reacción de conversión de metano → metanol catalizada por metano monooxigenasa: un estudio funcional de densidad. En: Revista de la Sociedad Química Estadounidense . 121, 1999, págs. 7249-7256, doi: 10.1021 / ja9906296 .
- ↑ Daniel Desbruyeres, André Toulmond: Una nueva especie de gusano hesionid, hesiocaeca methanicola sp nov (Polychaeta: Hesionidae), que vive en hidratos de metano similares al hielo en las profundidades del Golfo de México. En: Cahiers de biologie marine . 39.1, 1998, págs. 93-98.
- ↑ Greg W. Rouse, Jose Ignacio Carvajal, Fredrik Pleijel: Phylogeny of Hesionidae (Aciculata, Annelida), con cuatro nuevas especies de filtraciones de metano en aguas profundas del Pacífico oriental y resolución de la afinidad de Hesiolyra. En: Sistemática de invertebrados . 32, 2018, págs. 1050-1068, doi: 10.1071 / IS17092 .
- ↑ CR Fisher et al.: Gusanos de hielo de metano: Hesiocaeca methanicola colonizando reservas de combustibles fósiles. En: Ciencias Naturales . 87.4, 2000, págs. 184-187.
- ^ Ian R. MacDonald, William W. Sager, Michael B. Peccini: Hidrato de gas y biota quimiosintética en batimetría de montículos en filtraciones de hidrocarburos de pendiente media: Norte del Golfo de México. En: Geología Marina . 198, 2003, págs. 133-158, doi: 10.1016 / S0025-3227 (03) 00098-7 .
- ↑ JJ Childress et al .: Una simbiosis de molusco marino metanotrófico (Bivalvia, Mytilidae): mejillones alimentados por gas. En: Ciencia . 233, 1986, págs. 1306-1308, doi: 10.1126 / science.233.4770.1306 .
- ↑ Julia Klose et al.: Los endosimbiontes escapan de los gusanos de los tubos de ventilación hidrotermales muertos para enriquecer la población de vida libre. En: Actas de la Academia Nacional de Ciencias . 112, 2015, págs. 11300-11305, doi: 10.1073 / pnas.1501160112 .
- ↑ G. Myhre et al.: Forzamiento radiativo antropogénico y natural. En: Cambio climático 2013: The Physical Science Basis. Contribución del Grupo de Trabajo I al Quinto Informe de Evaluación del Panel Intergubernamental sobre Cambio Climático. Cambridge University Press, Cambridge / Nueva York 2013, pág.714, (PDF)
- ↑ Hans Oeschger: Clima pasado - Clima futuro. En: Hubert Markl et al. (Ed.): La ciencia en el desafío global. S. Hirzel Wissenschaftlich Verlagsgesellschaft, Stuttgart, 1995, ISBN 3-8047-1417-X , págs. 115-126.
- ^ J. Kasting: metano y clima durante la era precámbrica. En: Investigación Precámbrica . 137, 2005, págs. 119-129, doi: 10.1016 / j.precamres.2005.03.002 .
- ↑ M. Kennedy, D. Mrofka, C. von der Borch: Terminación de la Tierra bola de nieve por desestabilización del clatrato de metano del permafrost ecuatorial. En: Naturaleza . 453, 2008, págs. 642-645, doi: 10.1038 / nature06961 .
- ^ Edward J. Brook et al.: Sobre el origen y el momento de los cambios rápidos en el metano atmosférico durante el último período glacial. En: Ciclos biogeoquímicos globales . 14, 2000, págs. 559-572, doi: 10.1029 / 1999GB001182 .
- ↑ Jürgen Willebrand: El papel de los océanos para el desarrollo climático. En: Hubert Markl et al. (Ed.): La ciencia en el desafío global. S. Hirzel Wissenschaftlich Verlagsgesellschaft, Stuttgart, 1995, ISBN 3-8047-1417-X , págs. 115-126.
- ↑ Tina Treude: Hidratos de metano: calentamiento, liberación y degradación microbiológica. En: JL Lozán, H. Graßl, K. Reise (Ed.): Señal de advertencia clima: Los mares - cambios y riesgos. Evaluaciones científicas, Hamburgo, ISBN 978-3-9809668-5-6 , págs. 178-182.
- ↑ Denis Chernykh et al.: Primera estimación cuantitativa de la creciente liberación de metano de los mares del Ártico de Siberia Oriental: desde una sola llamarada hasta una vasta área de filtración. En: Resúmenes de conferencias de la Asamblea General de EGU. 2020.
- ↑ Martin Kappas: Climatología: Investigación del clima en el desafío del siglo XXI para las ciencias naturales y sociales. Springer-Verlag, 2009, ISBN 978-3-8274-1827-2 , pág.202.
- ^ Petter Bryn, Kjell Berg, Carl F. Forsberg, Anders Solheim, Tore J. Kvalstad: Explicación de la diapositiva de Storegga. En: Geología Marina y del Petróleo . 22, 2005, págs. 11-19, doi: 10.1016 / j.marpetgeo.2004.12.003 .
- ^ Matthew J. Hornbach, Luc L. Lavier, Carolyn D. Ruppel: mecanismo de activación y potencial tsunamogénico del complejo Cape Fear Slide, margen atlántico de EE. UU. En: Geoquímica, Geofísica, Geosistemas . 8, 2007, págs. 1-16, doi: 10.1029 / 2007GC001722 .
- ↑ Nils-Axel Mörner: Hidrato de metano en lecho rocoso cristalino y tectónica explosiva de ventilación de metano. En: Earth-Science Reviews . 169, 2017, págs.202-212, doi: 10.1016 / j.earscirev.2017.05.003 .
- ↑ David Deming: '¿Puede una sola burbuja hundir un barco?' . En: Revista de Exploración Científica . 18.2, 2004, págs. 307-312.
- ↑ Nabil Sultan, Andreia Plaza-Faverola, Sunil Vadakkepuliyambatta, Stefan Buenz, Jochen Knies: Impacto de las mareas y el nivel del mar en las emisiones de metano del Ártico en aguas profundas. En: Nature Communications . 11, 2020, pág.5087, doi: 10.1038 / s41467-020-18899-3 .
- ↑ a b Pinnelli SR Prasad, Vangala Dhanunjana Chari: Preservación del gas metano en forma de hidratos: Uso de hidratos mixtos. En: Revista de Ciencia e Ingeniería del Gas Natural . 25, 2015, págs. 10-14, doi: 10.1016 / j.jngse.2015.04.030 .
- ↑ Emmanuel Dartois, Mehdi Bouzit, Bernard Schmitt: Hidratos de clatrato: espectroscopia FTIR para detección remota astrofísica. En: Serie de publicaciones de EAS . 58, 2012, págs. 219-224.