Proceso de Wacker-Hoechst
El proceso Wacker-Hoechst es un proceso a gran escala en la industria química en el que la oxidación del etileno en presencia de cloruro de paladio (II) como catalizador produce acetaldehído . El oxígeno de la función aldehído resultante proviene del agua utilizada como disolvente; el oxígeno usado en el proceso se usa para reoxidar el catalizador.
La capacidad de producción instalada en 2009 fue de alrededor de dos millones de toneladas por año. El acetaldehído es una materia prima importante en la industria química y se utiliza principalmente en la producción de ácido acético y anhídrido acético ; otros productos secundarios son 1,3-butadieno , acroleína y pentaeritritol .
Walter Hafner , Jürgen Smidt , Reinhard Jira y otros empleados de Wacker Chemie desarrollaron el proceso en el Wacker Research Center, el consorcio para la industria electroquímica , a finales de la década de 1950 . Fue el primero en utilizar un compuesto de paladio como catalizador a escala industrial .
La publicación del proceso dio lugar a una intensa actividad de investigación en el campo de las reacciones de olefinas catalizadas por paladio en el campo técnico y químico-preparativo y dio lugar a numerosos estudios mecanicistas de la reacción. Además de las diversas rutas sintéticas que se han elaborado para las olefinas superiores, Hoechst desarrolló un proceso técnico basado en el proceso Wacker-Hoechst en el que la acetona disolvente se obtiene a partir del propileno , que a su vez es el material de partida para muchas síntesis.
historia
Los procesos químicos a gran escala puestos en funcionamiento en Alemania inmediatamente después de la Segunda Guerra Mundial todavía se basaban en la química del carbón de los períodos de preguerra y de guerra. Uno de los componentes básicos de esta química era el acetileno de la hidrólisis del carburo de calcio , que a su vez se obtenía del óxido de calcio y el carbón. Wacker-Chemie produjo el importante bloque de construcción sintético acetaldehído a partir de acetileno utilizando el primer proceso de Wacker .
Sin embargo, la producción de acetileno requirió un alto nivel de aporte de energía, mientras que las olefinas del petróleo se volvieron más accesibles después de la guerra y, por lo tanto, representaron materias primas más baratas para la síntesis química. El etileno de las plantas de craqueo petroquímico estaba disponible en grandes cantidades desde mediados de la década de 1950. Procesos como la oxidación de etileno a acetileno utilizado por la Azienda Nazionale Idrogenazione Combustibili (ANIC) en Ravenna , Italia , que a su vez se convirtió en acetaldehído según el proceso First Wacker, demostraron ser energéticamente desfavorables y no fueron ampliamente utilizados.
Para la preparación de acetaldehído, Wacker buscaba, por tanto, un proceso basado en la oxidación directa del etileno. El punto de partida de esta búsqueda fue la oxidación estequiométrica de eteno a acetaldehído utilizando cloruro de paladio (II) en solución acuosa , que Francis C. Phillips había descubierto desde 1894 . En esta reacción, la sal de paladio se redujo a paladio metálico, se precipitó y no estuvo disponible para más reacciones de oxidación.
A finales de la década de 1950, los investigadores de Wacker-Chemie buscaban una variante catalítica de esta reacción. Inicialmente, la búsqueda se centró en un proceso catalítico heterogéneo . Hafner encontró trazas olfativas de acetaldehído en experimentos en los que condujo etileno y oxígeno con trazas de hidrógeno sobre un contacto de paladio heterogéneo . Además de las reacciones catalíticas heterogéneas en fase gaseosa, el consorcio también investigó la reacción del etileno en la fase acuosa. La observación de que el paladio metálico puede volver a oxidarse a cloruro de paladio (II) con cloruro de cobre (II) fue uno de los factores decisivos para el desarrollo del proceso catalítico en solución acuosa. Se sabía que la oxidación de cobre (I) a cloruro de cobre (II) por oxígeno era una reacción rápida. Un método similar de regeneración de catalizadores, la reoxidación de mercurio metálico utilizando cloruro de hierro (III) , ya se conocía del primer proceso de Wacker.
Wacker-Chemie decidió dividir la patente en tres solicitudes de patente. La nueva planta que se iba a construir se iba a construir en Colonia, cerca de una planta petroquímica de Esso que supuestamente suministraría el etileno. Los detalles del procedimiento se comunicaron a Hoechst en relación con las conversaciones sobre la adquisición de la propiedad, a las que Hoechst, como socio de Wacker-Chemie, tuvo que estar de acuerdo. Luego, Hoechst emprendió actividades de investigación sobre la oxidación del etileno y colocó su propia patente entre la segunda y la tercera solicitud de patente de Wacker-Chemie. Esto le dio a Hoechst un derecho parcial al proceso, después de lo cual Wacker y Hoechst fundaron la empresa conjunta Aldehyd GmbH , que se hizo cargo de la comercialización de la patente. Dado que no había oxígeno puro disponible a precios aceptables para la ubicación planificada de Colonia , Wacker-Chemie desarrolló posteriormente un proceso de dos pasos que trabajaba con oxígeno atmosférico como agente oxidante. El primer sistema basado en el proceso de dos etapas se puso en funcionamiento en Colonia en enero de 1960 ( Lage ). Wolfgang Hafner y Jürgen Smidt recibieron el premio DECHEMA en 1962 por su investigación y el desarrollo del proceso .
A lo largo de unos años, el proceso de Wacker-Hoechst sustituyó a procesos alternativos como la deshidrogenación catalítica o la oxidación del etanol . Fue uno de los primeros procesos químico-técnicos en señalar la importancia de los alquenos. Ya en 1969, pocos años después de la puesta en servicio de la primera planta, la capacidad instalada era de alrededor de 350.000 toneladas por año. En el cambio de milenio, la capacidad instalada era de alrededor de dos millones de toneladas por año. Se creía ampliamente que “la invención del proceso Wacker fue un triunfo del sentido común”.
Con el desarrollo de procesos más nuevos como el proceso Monsanto y el proceso Cativa para la producción de ácido acético a partir de metanol y monóxido de carbono , el proceso Wacker-Hoechst está perdiendo importancia.
El anhídrido acético se puede obtener a partir de acetato de metilo y monóxido de carbono usando el proceso de anhídrido acético Tennessee-Eastman .
Catalizador
El cloruro de paladio (II) se obtiene disolviendo paladio metálico en agua regia . Se disuelve fácilmente en ácido clorhídrico para formar tetracloropaladato.
Además de cloruro de cobre, de cobre (II) acetato de etilo , de cobre (II) nitrato , hierro (III) cloruro y otros agentes oxidantes tales como ácido nítrico o peróxido de hidrógeno se utilizan como reoxidants para el paladio metálico producido en el proceso . Cuando se utilizan agentes oxidantes sin cloruro , se reduce la formación de subproductos clorados, incluido el cloroacetaldehído .
Procedimiento
El proceso Wacker-Hoechst se puede realizar en una o dos etapas. El rendimiento basado en etileno para ambos procesos es aproximadamente del 95%. Los subproductos son productos clorados y más altamente oxidados de etileno y acetaldehído. En el proceso de dos etapas, el requisito de pureza del etileno es menor que en el proceso de una etapa. Sin embargo, los costos de inversión en los sistemas y el consumo de energía son mayores en el proceso de dos etapas, por lo que se prefiere el proceso de una sola etapa si se garantiza el suministro de oxígeno puro.
Proceso de un solo paso
En el proceso de una etapa, la oxidación del eteno y la regeneración del catalizador se llevan a cabo en un reactor a temperaturas de aproximadamente 120 a 130ºC y presiones de 3 a 4 bar. La regeneración se realiza con oxígeno puro y el eteno utilizado debe ser muy puro. Para mantenerse por debajo del límite de explosión, se utiliza un exceso de eteno, lo que reduce el rendimiento a alrededor del 35%. Sin embargo, el eteno no convertido se puede retroalimentar al reactor.
El acetaldehído bruto resultante contiene componentes de bajo punto de ebullición, como cloruro de metilo , cloruro de etilo o dióxido de carbono , que se separan por destilación extractiva . La fracción de acetaldehído resultante todavía contiene componentes de alto punto de ebullición tales como acetaldehído clorado, cloroformo , cloruro de metileno , 1,2-dicloroetano , 2-cloroetanol y ácido acético, que se separan por destilación fraccionada .
Los reactores utilizados están provistos de un revestimiento cerámico debido a las propiedades corrosivas de la solución catalizadora. Las tuberías y bombas están hechas de titanio por la misma razón . El uso de estos materiales de baja conductividad térmica es posible porque el calor de reacción puede disiparse mediante la evaporación de acetaldehído y agua.
Proceso de dos pasos
En el proceso de dos etapas, la oxidación del eteno y la regeneración del catalizador se separan espacialmente. Primero, en ausencia de oxígeno, el eteno reacciona estequiométricamente con el cloruro de paladio y el agua de proceso en el reactor de oxidación de titanio, generalmente un reactor de columna de burbujas , a presiones de alrededor de 10 bar y temperaturas entre 100 y 110 ° C para formar acetaldehído y metal paladio. Después de la relajación a presión normal, el acetaldehído crudo se separa del agua de proceso y luego se purifica por destilación.
La solución que contiene paladio y cobre se bombea a otro reactor de columna de burbujas y allí se regenera. Puede regenerarse con oxígeno atmosférico.
Wacker-Chemie puso en marcha el primer sistema basado en el proceso de dos etapas en enero de 1960 en la planta de Colonia-Merkenich. Fue la primera planta química del mundo con aparatos hechos de titanio.
Productos
El principal producto del proceso de Wacker-Hoechst es el acetaldehído, que tiene una rica química posterior. Alrededor del 80% del acetaldehído producido se procesa en ácido acético y anhídrido acético, y el 20% restante se utiliza para fabricar una gran cantidad de otros productos. El ácido acético se produjo oxidando acetaldehído utilizando acetato de manganeso (II) como catalizador, un proceso que también fue desarrollado por Wacker-Chemie:
La sal de manganeso cataliza la descomposición del ácido peroxiacético que se forma principalmente .
Por ejemplo, el 1,3-butadieno se produjo en el proceso Lebedew mediante la adición aldólica de dos moléculas de acetaldehído.
al crotonaldehído , que reacciona con el etanol a temperaturas de entre 380 y 500 ° C para formar 1,3-butadieno, acetaldehído y agua. En un proceso similar al proceso Lebedev, que fue desarrollado por el químico ruso Iwan Ostromislenski , el etanol reacciona directamente con acetaldehído a temperaturas de alrededor de 325 a 350 ° C sobre un catalizador de sílice modificado con tantalio para formar 1,3-butadieno. La acroleína se forma a partir de la adición aldólica de formaldehído a acetaldehído. El pentaeritritol también se produce a partir de la adición aldólica de formaldehído y acetaldehído.
Mecanismo de reacción
El mecanismo de reacción se ha estudiado intensamente durante décadas, no solo por la importancia industrial de la reacción, sino también porque marcó el comienzo de la química catalítica del paladio.
En el primer paso del mecanismo de reacción, el cloruro de paladio (II), el eteno y un ión cloruro forman un complejo aniónico de paladio (II) -eteno equivalente a la sal de Zeise , el anión tricloridoetileno paladinato (II) (arriba a la derecha en la figura). A partir de estudios de reacciones de sustitución de la sal de Zeise, se sabía que el ligando de eteno tiene un fuerte efecto trans . Esto debilita la unión del ligando de cloruro trans y facilita la adición de agua (un ligando aquo) mientras se desplaza un ligando de cloruro. Este intercambio crea un complejo neutro de paladio (II) -eteno (figura en el centro a la derecha). Se forma de nuevo un complejo aniónico eteno-hidroxo por desprotonación. Se forma un complejo de 2-hidroxietilo añadiendo agua e insertando el ligando de eteno en el enlace Pd-OH.
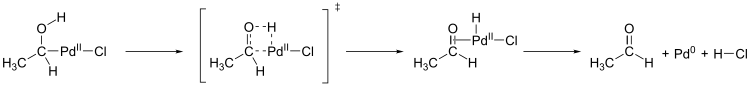
Otro paso importante en el proceso de Wacker es la migración de hidrógeno del oxígeno al cloruro y la formación del doble enlace CO (figura de abajo a arriba a la izquierda). Se desconoce el mecanismo exacto de este paso. Una hipótesis es una eliminación de hidruro β en un estado de transición cíclico de cuatro miembros:
Sin embargo, los cálculos mostraron que un estado de transición de cuatro miembros con eliminación de hidruro β es energéticamente desfavorable para esta etapa de reacción (151 kJ / mol). Un estado de transición de cinco miembros apoyado por moléculas de agua con posterior eliminación reductora es energéticamente más favorable (78,6 kJ / mol) y, por lo tanto, se considera más probable:
El ciclo catalítico en curso (ver figura) se puede resumir en las siguientes ecuaciones de equilibrio:
con el balance general:
Las reacciones parciales a) ac) se pueden representar como reacciones parciales acopladas:
El mecanismo exacto de la reacción ha sido durante mucho tiempo objeto de estudios cinéticos y mecanicistas. Los primeros estudios cinéticos proporcionaron una ecuación de velocidad de primer orden con respecto al tetracloropalladato y etileno, y mostraron una inhibición de primer orden con respecto al protón y una inhibición de segundo orden con respecto al ion cloruro.
Mientras que el efecto inhibidor del cloruro se debe a las rápidas reacciones de equilibrio
Explicado, había varias explicaciones para el efecto inhibidor del protón.
La oxidación de etileno C 2 H 4 no deuterado en agua pesada D 2 O solo condujo a la formación de acetaldehído no deuterado CH 3 CHO. Por el contrario, la oxidación de etileno C 2 D 4 deuterado en agua normal H 2 O solo condujo a la formación de acetaldehído CD 3 CDO deuterado . A través de estos experimentos , se podría refutar la tesis de que el proceso tiene lugar a través de una etapa intermedia de alcohol vinílico, en la que un átomo de hidrógeno en el acetaldehído debe provenir del agua , por ejemplo a través de una tautomería ceto-enólica , podría ser refutada.
Variantes de proceso
Si el proceso de Wacker-Hoechst utiliza una mezcla de ácido acético y acetatos alcalinos en lugar de agua como disolvente, el acetato de vinilo es el producto principal, que es el monómero para la producción de acetato de polivinilo y, por tanto, de alcohol polivinílico .
Este proceso catalítico homogéneo fue reemplazado desde el principio por un proceso de oxidación catalítica heterogéneo basado en un contacto de paladio. Se pueden utilizar varios disolventes distintos del ácido acético. Con alcoholes como disolvente, normalmente se forman acetales , con dioles la formación de 1,3-dioxolanos.
El propileno se puede oxidar a acetona mediante el proceso de Wacker-Hoechst. La reacción tiene lugar a una temperatura de aproximadamente 110 a 120ºC y una presión de 10 a 14 bares. Como ocurre con la oxidación del etileno, el paladio metálico se reoxida con cloruro de cobre. La selectividad por acetona es del 92%. El subproducto propionaldehído . El proceso se puede realizar en una o dos etapas. Las únicas plantas industriales que utilizan este proceso se construyeron y operaron en Japón. No se pudo establecer un proceso desarrollado por Wacker para la oxidación de 1-buteno a metiletilcetona .
Oxidación de Wacker
Además de los procesos industriales a gran escala, la reacción en la que se basa el proceso de Wacker-Hoechst se conoce como oxidación de Wacker y se utiliza en síntesis de laboratorio, por ejemplo en forma de oxidación de Wacker-Tsuji . Esto implica la oxidación de α-olefinas superiores a metil cetonas , como la oxidación de 1-deceno a 2-decanona .
En general, los alquenos altamente sustituidos reaccionan más rápido que los no sustituidos y los dienos con dobles enlaces conjugados reaccionan más lentamente que los sistemas no conjugados. La formación del producto sigue la regla de Markovnikov , según la cual el átomo de hidrógeno siempre está unido al átomo de carbono ya rico en hidrógeno.
A escala de laboratorio, la reacción se lleva a cabo habitualmente a temperatura ambiente con cloruro de paladio (II) y cloruro de cobre (II) bajo una atmósfera de oxígeno. Para evitar reacciones de cloración, además del sistema clásico de paladio / cloruro de cobre, se utilizan otros sistemas de paladio soluble como acetato de paladio (II) o bis (acetonitrilo) cloronitropaladio (II). Los ácidos inorgánicos fuertes, como el ácido perclórico, a veces aumentan la velocidad de reacción. La velocidad de reacción de oxidación de alquenos superiores poco solubles en agua puede aumentarse utilizando mezclas de agua y disolventes orgánicos polares como dimetilformamida o N -metil-2-pirrolidona o utilizando sustancias tensioactivas como lauril sulfato de sodio . La isomerización de doble enlace se puede observar como una reacción secundaria común; la velocidad de reacción de esta reacción secundaria parece depender en gran medida de la elección del disolvente. Además del cloruro de cobre clásico, se utilizan varios agentes oxidantes para volver a oxidar el metal paladio resultante en condiciones de laboratorio.
literatura
- Patrick Henry: Oxidación de hidrocarburos catalizada por paladio (catálisis por complejos metálicos). Verlag Springer, 1980, ISBN 978-94-009-9448-5 .
enlaces web
Evidencia individual
- ↑ a b c d e f g h Reinhard Jira: Acetaldehído de etileno: una mirada al descubrimiento del proceso de Wacker. En: Angewandte Chemie. 121, 2009, págs. 9196-9199, doi: 10.1002 / anie.200903992 .
- ^ Albert Hester, Karl Himmler: Productos químicos de acetaldehído. En: Química Industrial y de Ingeniería. 51.12, 1959, págs. 1424-1430.
- ^ Francis C. Phillips, Am. Chem. J., 1894, 16, págs. 255-277.
- ↑ a b c d e Personas • Mercados • Moléculas: La fórmula de Wacker Chemie para el éxito entre 1914 y 2014, p. 154 y p. 175-185 ( pdf ) .
- ↑ a b c d John A. Keith, Patrick M. Henry: Sobre el mecanismo de la reacción de Wacker: ¡dos hidroxipalaciones! En: Angewandte Chemie. 121, 2009, págs. 9200-9212, doi: 10.1002 / anie.200902194 .
- ^ Los galardonados de DECHEMA desde 1951 .
- ^ A b Marc Eckert, Gerald Fleischmann, Reinhard Jira, Hermann M. Bolt, Klaus Golka: Acetaldehído. En: Enciclopedia de química industrial de Ullmann , 2005, Weinheim, Wiley-VCH, doi : 10.1002 / 14356007.a01_031.pub2 .
- ↑ James A. Kent (Ed.): Manual de química industrial de Riegel. 7ª edición. Van Nostrand Reinhold Verlag, ISBN 0-442-24347-2 , pág.790 .
- ↑ George W. Parshall, Steven D. Ittel: Catálisis homogénea. Wiley, Nueva York 1992, ISBN 978-0-471-53829-5 , p. 138.
- ↑ Glenn J. Sunley, Derrick J. Watson: Catálisis de carbonilación de metanol de alta productividad usando iridio. En: Catálisis hoy. 58, 2000, págs. 293-307, doi: 10.1016 / S0920-5861 (00) 00263-7 .
- ^ Joseph R. Zoeller, Victor H. Agreda, Steven L. Cook, Norma L. Lafferty, Stanley W. Polichnowski, David M. Pond: Proceso de anhídrido acético de la compañía química Eastman. En: Catálisis hoy. 13, 1992, págs. 73-91, doi: 10.1016 / 0920-5861 (92) 80188-S .
- ^ Adolph Segnitz: s-Organocobalto, - rodio, -iridio, -níquel, -compuestos de paladio. En: Houben-Weyl Methods of Organic Chemistry Vol. XIII / 9b, 4ª edición. Georg Thieme Verlag, 1984, ISBN 978-3-13-215004-1 , pág.882 .
- ↑ a b c Jürgen Smidt, W. Hafner, R. Jira, R. Sieber, J. Sedlmeier, A. Sabel: La oxidación de olefinas con catalizadores de cloruro de paladio. En: Angewandte Chemie International Edition en inglés. 1, 1962, págs. 80-88, doi: 10.1002 / anie.196200801 .
- ^ A b Wilhelm Keim, Arno Behr y Günter Schmitt: Fundamentos de la química industrial. Productos y procesos técnicos. ISBN 3-7935-5490-2 (Salle), ISBN 3-7941-2553-3 (Sauerländer), págs. 217-223.
- ↑ Boy Cornils, Wolfgang A. Herrmann, Chi-Huey Wong, Horst-Werner Zanthoff: Catálisis de la A a la Z: Una enciclopedia concisa . Verlag Wiley-VCH, 2012, ISBN 3-527-33307-X , p. 337.
- ↑ H. Schulz, H. Wagner: Productos de síntesis y conversión de acroleína. En: Angewandte Chemie. 62, 1950, págs. 105-118, doi: 10.1002 / anie.19500620502 .
- ^ P. Rave, B. Tollens: XXXIV. Sobre el penta-eritritol (tetrametilolmetano). En: Annals of Chemistry de Justus Liebig. 276, 1893, págs. 58-69, doi: 10.1002 / jlac.18932760106 .
- ↑ Ido Leden, Joseph Chatt: Las constantes de estabilidad de algunos complejos de haluro platinoso. En: Revista de la Sociedad Química. 1955, págs. 2936-2943, doi: 10.1039 / JR9550002936 .
- ↑ a b c Dirk Steinborn: Fundamentos de la catálisis de complejos organometálicos. Teubner, Wiesbaden 2007, ISBN 978-3-8351-0088-6 , págs. 283-292.
- ↑ John A. Keith, Jonas Oxgaard, William A. Goddard: Inaccesibilidad de la eliminación del hidruro β de los grupos funcionales -OH en la oxidación tipo Wacker. En: Revista de la Sociedad Química Estadounidense. 128, 2006, págs. 3132-3133, doi: 10.1021 / ja0533139 .
- ^ Wilhelm Keim: Catálisis homogénea en Alemania: pasado y presente. En: Estudios en Ciencias de Superficies y Catálisis. 44, 1989, págs. 321-331.
- ↑ W. Schwerdtel: acetal de vinilo a base de etileno en fase gaseosa. En: Tecnología de Ingeniería Química. 40, 1968, págs. 781-784, doi: 10.1002 / cite.330401602 .
- ^ William G. Lloyd, BJ Luberoff: Oxidaciones de olefinas con sales alcohólicas de paladio (II). En: The Journal of Organic Chemistry. 34, 1969, págs. 3949-3952, doi: 10.1021 / jo01264a043 .
- ↑ Gian Paolo Chiusoli, Peter M. Maitlis: catálisis de metales en procesos orgánicos industriales . RSC Publishing, 2008, ISBN 978-0-85404-150-3 , pág.69.
- ↑ Jiro Tsuji, Hideo Nagashima, Hisao Nemoto: Un método sintético general para la preparación de metil cetonas a partir de olefinas terminales: 2-Decanona. En: Síntesis orgánica. 62, 1984, pág.9 , doi: 10.15227 / orgsyn.062.0009 .
- ↑ Michael B. Smith: Síntesis orgánica. Primera edición, McGraw-Hill, 1994, ISBN 0-07-113909-5 , págs. 1350-1353.
- ↑ a b James Takacs, Xun-tian Jiang: La reacción de Wacker y reacciones de oxidación de alquenos relacionados. En: Química Orgánica Actual. 7, 2003, págs. 369-396, doi: 10.2174 / 1385272033372851 .





![{\ Displaystyle \ mathrm {PdCl_ {2} +2 \ Cl ^ {-} \ longrightarrow [PdCl_ {4}] ^ {2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/504c823774a42766727a9042bad20d59757c7876)






![{\ Displaystyle \ mathrm {(a) \ [PdCl_ {4}] ^ {2 -} + C_ {2} H_ {4} + H_ {2} O \ rightarrow CH_ {3} CHO + Pd + 2 \ HCl + 2 \ Cl ^ {-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/272108c37754118dfc7ea70418d73f1f4ba6136b)
![{\ Displaystyle \ mathrm {(b) \ Pd + 2 \ CuCl_ {2} +2 \ Cl ^ {-} \ rightarrow [PdCl_ {4}] ^ {2 -} + 2 \ CuCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a62f373f2a6e8dc8a4d03e4c022bddbf3a443)



![{\ Displaystyle v = {\ frac {k [\ mathrm {PdCl_ {4} ^ {2-}}] \ cdot [\ mathrm {C_ {2} H_ {4}}]} {[\ mathrm {H ^ { +}}] \ cdot [\ mathrm {Cl ^ {-}}] ^ {2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d9319e4cb8cae7eafab2012d902a1c72de66b9a)
![{\ Displaystyle \ mathrm {\ [PdCl_ {4}] ^ {2 -} + C_ {2} H_ {4} \ rightleftharpoons [PdCl_ {3} (C_ {2} H_ {4})] ^ {-} + Cl ^ {-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a8323b0d4f43fcf81ceaf710c7ddf620212abfa)
![{\ Displaystyle \ mathrm {\ [PdCl_ {3} (C_ {2} H_ {4})] ^ {-} + H_ {2} O \ rightleftharpoons [PdCl_ {2} (C_ {2} H_ {4}) (H_ {2} O)] + Cl ^ {-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/01f4bfe55d7c7ee925c1095080ff61ed126c481f)

