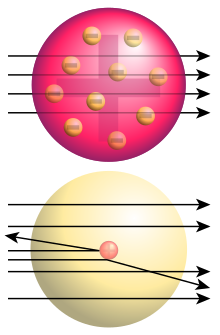
El modelo atómico de Rutherford
El modelo del átomo de Rutherford es un modelo del átomo que fue establecido por Ernest Rutherford entre 1909 y 1911 . Forma la base de la imagen actual del átomo al introducir el núcleo atómico , que como una esfera extremadamente pequeña y cargada positivamente en el centro del átomo tiene casi toda su masa. Así que el modelo atómico de Rutherford superó al modelo atómico de Thomson erigido en 1904 y sirvió a su vez en 1913 como el punto de partida del modelo de Bohr del átomo , los niveles de energía de la capa atómica pudieron describirse por primera vez con éxito.
visión de conjunto
Hasta el experimento de dispersión de Rutherford (1909) de Hans Geiger , Ernest Marsden y Ernest Rutherford, solo se sabía que los átomos contienen electrones cargados negativamente y la misma cantidad de cargas positivas . Un intento adecuado de explicar la estructura atómica fue el modelo atómico de Thomson , según el cual cada átomo consiste en una carga positiva uniformemente distribuida en la que los electrones se mueven bajo el efecto de fuerzas electrostáticas. La prueba de dispersión de Rutherford mostró que este modelo no representa la realidad. La totalidad de las cargas positivas del átomo y prácticamente toda su masa deben combinarse en un núcleo atómico, cuyo tamaño es solo una pequeña fracción del átomo total.
El intento
Los colegas de Rutherford, Hans Geiger y Ernest Marsden, llevaron a cabo experimentos con partículas alfa de alta energía de la radiactividad natural del bismuto-214 . Inicialmente, se observó que algunas de las partículas alfa fueron arrojadas hacia atrás desde una placa de platino . Eso fue completamente inesperado, porque hasta ahora solo se habían determinado las desviaciones de las partículas alfa en unos pocos grados, y no se podía explicar con ideas previas del átomo.
En una configuración experimental refinada, la distribución de frecuencia de los ángulos de deflexión entre 15 ° y 170 ° se examinó al vacío con láminas delgadas de diferentes metales, incluido el oro. Aquí, también, se demostró que los ángulos de deflexión eran significativamente mayores de lo que puede explicarse por la colisión de las partículas alfa con los electrones comparativamente muy ligeros, y que aproximadamente una de cada 8000 partículas alfa fue rechazada por completo.
"Fue casi tan increíble como si dispararas un proyectil de 15 pulgadas a un pedazo de papel de seda y volviera y te golpeara".
"Fue casi tan increíble como si dispararas un trozo de papel de seda con una bala de 15 pulgadas y la bala regresara y te golpeara".
El modelo de Rutherford
De la idea recién concebida de que hay un núcleo pequeño, pesado y cargado eléctricamente en el átomo, Rutherford derivó la fórmula de dispersión que lleva su nombre . Esto podría explicar la frecuencia observada de grandes ángulos de deflexión si el núcleo no es mayor que 1/3000 del radio atómico y su carga eléctrica (en unidades de la carga elemental) corresponde aproximadamente al número atómico atómico.
Para explicar la neutralidad eléctrica de los átomos, Rutherford asumió que el núcleo está cargado positivamente y está rodeado de electrones, el número de número atómico corresponde. No se pudo obtener más información sobre la distribución espacial de los electrones, ya que los electrones, debido a su baja masa, no contribuyen a la deflexión de las partículas alfa en ángulos grandes. Al contrario de lo que se encuentra a menudo en los libros de texto y otras fuentes secundarias, Rutherford no desarrolló su propio modelo de la estructura electrónica de los átomos. En 1911 de febrero, cuando presentó su modelo a la literaria y filosófica Sociedad Manchester, citó de Nagaoka “ modelo planetario ” en el fin de hacer que su estimación del número atómico del oro plausibles.
Límites del modelo
Según el modelo de Rutherford, los electrones orbitarían el núcleo en las órbitas de Kepler , que, como en el sistema planetario , podrían tener cualquier expansión, excentricidad y orientación. Sin embargo, estas órbitas no podrían ser estables, porque una carga circular y, por lo tanto, acelerada irradia energía constantemente de acuerdo con las leyes de la electrodinámica . Un electrón que cayera en el núcleo generaría ondas electromagnéticas de cualquier frecuencia, pero esto contradice la observación de líneas espectrales con frecuencias específicas según el tipo de átomo.
Evidencia individual
- ↑ Jörn Bleck-Neuhaus: Partículas elementales . De los átomos al modelo estándar al bosón de Higgs. 2ª edición revisada. Springer, 2013, ISBN 978-3-642-32578-6 , ISSN 0937-7433 , pág. 49 , doi : 10.1007 / 978-3-642-32579-3 .
- ↑ Hans Geiger, Ernest Marsden: Sobre un reflejo difuso de las partículas α . En: Actas de la Royal Society . 82A, 1909, págs. 495-500. Consultado el 25 de octubre de 2010.
- ^ Edward Andrade : Rutherford y la naturaleza del átomo. Doubleday New York 1964. Citado de: Laylin K. James: Premios Nobel de Química, 1901-1992 , p. 57
- ↑ a b E. Rutherford, La dispersión de partículas α y β por la materia y la estructura del átomo , Phil. Mag. 6, vol. 21, 669 - 688 (1911). Artículo de Rutherford en Philosophical Magazine (inglés, PDF; 233 kB)
- ↑ Hantarō Nagaoka: Cinética de un sistema de partículas que ilustra la línea y el espectro de bandas y los fenómenos de radioactividad . En: Revista Filosófica . 7, 1904, págs. 445-455. Consultado el 28 de febrero de 2010.