Proceso Linde

El proceso Linde es un método técnico para la separación de gases desarrollado por Carl von Linde en 1895 , que permite la licuefacción de mezclas de gases como el aire y gases atmosféricos individuales como oxígeno , nitrógeno y argón ( gases nobles ) en grandes cantidades y, en este caso, En ese sentido, se utiliza la generación de frío en el rango de temperatura de 77 a 100 Kelvin (K).
historia
Aunque inicialmente solo se usó con fines académicos, se usó por primera vez en la industria ya en 1902 como una parte importante de la planta de separación de aire (abreviatura técnica: LZA) también desarrollada por Carl von Linde. Incluso hoy en día, las plantas de separación de aire se utilizan a gran escala para extraer oxígeno líquido y gaseoso (GOX y LOX (del oxígeno líquido), como códigos de tecnología), nitrógeno (GAN y LIN ) y gases nobles . Por el contrario, el proceso Linde en su estructura original ya no se utiliza para generar frío, ya que mientras tanto se han desarrollado implementaciones técnicas más eficientes (expansores de pistón alternativo o turbinas de expansión ). Su generación de frío ya no se basa en el efecto Joule-Thomson puro del proceso Linde original, sino en lograr un enfriamiento tan adiabático como sea posible mientras se obtiene energía mecánica útil del gas en expansión. En el proceso Linde original, por otro lado, o en el efecto Joule-Thomson isentálpico de expansión del acelerador puro, esta energía no solo no se usa, sino que incluso permanece en el proceso como calor de fricción del acelerador que es dañino para el proceso. . Este z. B. una licuefacción de helio sin preenfriamiento con el proceso Linde isentálpico-expansión-acelerador puro original debido a la baja temperatura de inversión del helio imposible, pero con el proceso mejorado, porque la eliminación de energía mecánica útil durante la expansión de un gas en condiciones adiabáticas, independientemente del tipo de gas y la temperatura del gas, siempre se produce un enfriamiento. Por lo tanto, el uso del efecto Joule-Thomson todavía está en uso.
principio
La expansión isentálpica de un gas real en un acelerador va acompañada de un cambio en su temperatura ( efecto Joule-Thomson ). El modelo abstracto del gas ideal no muestra este efecto. Si el cambio de temperatura ocurre en forma de enfriamiento o calentamiento depende de si la temperatura ha caído por debajo de la temperatura de inversión (es decir, la temperatura a la que el coeficiente de Joule-Thomson del gas experimenta un cambio de signo). Si el sistema está por encima de la temperatura de inversión, el gas se calienta durante la expansión (más precisamente: expansión isentálpica, la entalpía no cambia debido al cambio de volumen), las temperaturas más bajas resultan en enfriamiento; este efecto se utiliza en el proceso Linde. (Nota: se produce una expansión isentálpica de acuerdo con la primera ley de la termodinámica en un acelerador si se puede despreciar el cambio en la energía potencial y cinética del fluido que fluye desde la entrada del acelerador a la salida del acelerador y se puede suponer que el acelerador está aislado adiabáticamente .)
Para alcanzar la temperatura de ebullición, que es baja para muchos gases (para oxígeno -183 ° C, para nitrógeno -196 ° C), el gas expandido se utiliza en el principio de contraflujo para preenfriar el gas comprimido.
usar
El proceso Linde se utilizó anteriormente para enfriar los gases atmosféricos oxígeno , nitrógeno , argón y otros gases nobles hasta que se licuaran.
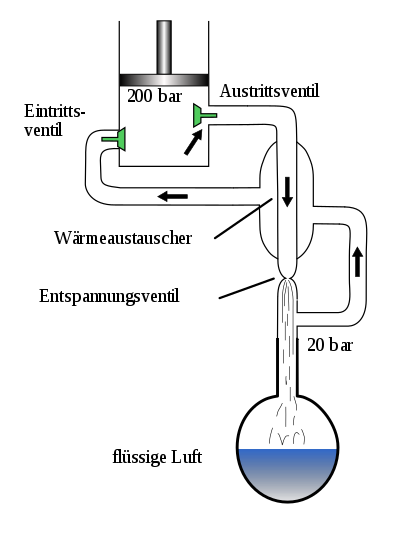
Licuefacción de aire
Un compresor comprime el aire a una presión de aproximadamente 200 bar . Su temperatura aumenta en aproximadamente 45 Kelvin, por ejemplo de +20 ° C a aproximadamente +65 ° C. A continuación, el aire comprimido calentado se enfría previamente en un primer intercambiador de calor y la temperatura vuelve al intervalo de temperatura ambiente. En el proceso, el calor se libera del sistema de licuefacción de aire al medio ambiente. El aire se lava primero y se libera del vapor de agua, el polvo, los hidrocarburos, el óxido nitroso y el dióxido de carbono mediante un tamiz molecular . Los hidrocarburos y el óxido nitroso pueden provocar una deflagración o incluso una explosión en la columna de rectificación . Luego, el aire se expande mediante una turbina, por lo que la temperatura del aire desciende hasta justo antes del punto de licuefacción. Luego, el aire pasa a través de una válvula de mariposa, donde el aire alcanza el punto de condensación (aproximadamente −170 ° C).
El ingeniero Fränkl logró reemplazar los recuperadores de contracorriente por regeneradores. Estos se pueden construir mucho más pequeños, más baratos y más potentes que los intercambiadores de calor de haz de tubos a contraflujo . Esta invención fue adquirida por Linde AG y comercializada con el nombre de Linde-Fränkl-Verfahren. El proceso con regeneradores se utilizó con éxito hasta alrededor de 1990, cuando surgió una tecnología más nueva que nuevamente incluía intercambiadores de calor de placas a contracorriente recuperativos con secado y limpieza por adsorción aguas arriba.
El aire líquido tiene una densidad de aproximadamente 875 kg / m³ (0,875 g / cm³). En un recipiente abierto a presión atmosférica, se asume una temperatura de -194,25 ° C = 78,9 K. Hierve en el proceso, de modo que se mantiene su temperatura baja, porque esto elimina la entalpía de vaporización del aire líquido . Dado que el oxígeno y el nitrógeno tienen diferentes temperaturas de ebullición, el nitrógeno se evapora más rápidamente y la temperatura de ebullición del líquido restante aumenta ligeramente, hasta 81,7 K. La cantidad de aire en ebullición se regula de tal manera que el calor suministrado por conducción de calor o radiación es igual a la entalpía de evaporación utilizada. Dependiendo del tamaño y el aislamiento del recipiente, el aire líquido se puede retener durante unas horas o varios días. Sin embargo, el aire líquido nunca debe almacenarse en recipientes cerrados sin dispositivos de seguridad y diseño adecuado, ya que la presión interna, que aumenta gradualmente debido al calentamiento gradual, hará que reviente.
Fraccionamiento del aire licuado
El aire líquido se puede descomponer en sus componentes mediante fraccionamiento, en el que se utilizan los diferentes puntos de ebullición de los componentes individuales del aire. Sin embargo, los puntos de ebullición del oxígeno y el nitrógeno están muy próximos. Por tanto, se utiliza una columna de rectificación : el aire líquido corre hacia abajo sobre varias bandejas de rectificación en contracorriente al gas ascendente. Absorbe oxígeno del gas y libera nitrógeno. La rectificación se realiza a una presión de aproximadamente 5-6 bar. Esto hace que el líquido contenga más oxígeno y el gas más nitrógeno.
Licuefacción de hidrógeno y helio
Para poder utilizar el proceso Linde para la licuefacción de hidrógeno y helio , estos gases deben preenfriarse primero por debajo de la temperatura de inversión . Esto generalmente se hace con aire líquido. El helio líquido finalmente obtenido hierve a presión atmosférica a 4,2 K. Este es el punto de ebullición más bajo de todos los elementos. Bombeando el helio gaseoso por encima del helio en ebullición, este último se retira de la entalpía de vaporización, de modo que su temperatura puede reducirse aún más. Sin embargo, dado que la presión de vapor cae muy bruscamente con la temperatura, este método no alcanza una temperatura inferior a 0,84 K; incluye la presión de vapor de 0,033 mbar.
Fundamentos físicos
El método Linde se basa en el efecto Joule-Thomson: en el gas ideal, las partículas no interactúan entre sí, por lo que la temperatura del gas ideal no depende del volumen. En el caso de los gases reales, en cambio, existen interacciones que pueden describirse con la ayuda de la ecuación de Van der Waals . El contenido de energía del gas real también cambia con la relajación adiabática (sin intercambio de calor) sin que se realice ningún trabajo externo. Esto se puede demostrar por el cambio de temperatura.
Si conecta dos contenedores de gas con una pared porosa y usa un pistón para empujar lentamente el gas a presión en la habitación 1 a través de esta membrana, que sirve para evitar remolinos y formación de chorros, en la habitación 2, que está bajo una presión constante pero menor que la habitación 1, entonces hay una pequeña diferencia de temperatura entre las dos habitaciones. Con dióxido de carbono es de aproximadamente 0,75 K por bar de diferencia de presión, con aire de aproximadamente 0,25 K.
Esto se puede explicar si considera que se ha eliminado el volumen de la habitación 1 . El pistón ha hecho el trabajo por el gas . La cantidad de gas aparece en el espacio 2 y tiene que hacer el trabajo contra el pistón. La diferencia de trabajo ha beneficiado al gas como energía interna.
- respectivamente.
La entalpía permanece constante. En Van der Waals, el gas es la energía interna , donde es el número de grados de libertad de una partícula.
Teniendo en cuenta la ecuación de Van der Waals , esto da como resultado :
Debido a que se retiene la entalpía, lo siguiente se aplica al diferencial total :
Transformado después del cambio de temperatura resulta:
El contador es positivo a alta temperatura. Cambia su signo a la temperatura de inversión .
Entonces, la temperatura crítica para un gas de van der Waals es .
Arriba , un gas se calienta cuando se libera, abajo se enfría. Para el dióxido de carbono y el aire está muy por encima de la temperatura ambiente, para el hidrógeno, sin embargo, a -80 ° C.
Por tanto, un valor alto de la constante de Van der Waals tiene el efecto de que la temperatura desciende bruscamente cuando se expande el gas real. Esto es lógico, porque cuando aumenta el volumen, las moléculas se alejan unas de otras y tienen que trabajar contra las fuerzas de atracción caracterizadas por . Este trabajo reduce la energía cinética de las moléculas y, por tanto, la temperatura del gas.
Procedimientos alternativos
Se utilizan dos procesos más nuevos para la producción más rentable de nitrógeno y oxígeno con una pureza adaptada a los requisitos:
- Membrana de separación de gas ( Inglés separación de gas de membrana (MGS) ): la difusión a través de la membrana de fibra hueca pueden ser nitrógeno de alta pureza y de oxígeno de grado de enriquecimiento de hasta un 40% suministrar aire comprimido.
- Por medio de la adsorción por cambio de presión ( adsorción por cambio de presión en inglés (PSA) ) en tamices moleculares , CMS - nitrógeno del tamiz molecular de carbono o zeolitas - el "tamiz molecular Zeo" es el oxígeno que se puede descomponer el aire a través del cambio de presión en dos recipientes a presión.
literatura
- Christian Gerthsen , Hans Otto Kneser , Helmut Vogel : Física: un libro de texto para usar además de las conferencias . 14ª edición. Springer, Berlín / Heidelberg 1982, ISBN 3-540-11369-X , capítulos 5.6.6 y 5.6.7.
- Georg Veranneman: gases técnicos. Producción, distribución, aplicación (= Biblioteca de tecnología , volumen 10), cuarta edición, Verlag Moderne Industrie, Landsberg am Lech 2000, ISBN 3-478-93229-7 .
enlaces web
- Vídeos de Linde que muestran visualmente el proceso de separación del aire:
- desde la perspectiva de la planta: https://www.youtube.com/watch?v=-mUKww4iPgw
- desde la perspectiva del gas: https://www.youtube.com/watch?v=flvW0vTQ1NM
- Información sobre licuadores de helio de Linde
- SVGs: Columna de separación , planta basada en el proceso de baja presión
- Vídeo: Efecto JOULE-THOMSON y método LINDE - ¿Cómo se crea aire líquido? . Jakob Günter Lauth (SciFox) 2013, disponible en la Biblioteca de información técnica (TIB), doi : 10.5446 / 15652 .
Evidencia individual
- ↑ Generador de nitrógeno - N2 AIRTEXX Gas Systems & Equipment recuperado el 27 de abril de 2013