Ecuación de Arrhenius
La ecuación de Arrhenius , que lleva el nombre de Svante Arrhenius , describe aproximadamente una dependencia cuantitativa de la temperatura en procesos físicos y, sobre todo, químicos en los que hay que superar una energía de activación a nivel molecular . Describe una relación fenomenológica y se aplica a un gran número de reacciones químicas. Está relacionado con la ecuación de Eyring , que es una conexión entre la interpretación microscópica.
Ecuación de Arrhenius en cinética de reacciones químicas
En cinética química, la ecuación de Arrhenius describe la dependencia cuantitativa de las constantes de velocidad de reacción de la temperatura para el caso especial de reacciones monomoleculares :
Con
- Factor pre-exponencial o frecuencia , según la teoría del impacto corresponde al producto del número de impacto Z y el factor de orientación P :
- Energía de activación (unidad: J mol −1 ),
- constante de gas universal (8.314 J K −1 mol −1 ),
- temperatura absoluta (termodinámica) (unidad: K ).
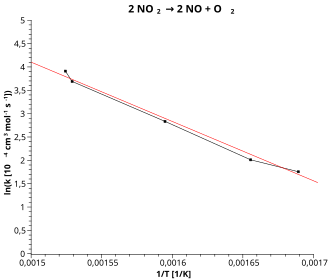
El gráfico de Arrhenius es una representación recíproca en la que la constante de velocidad logarítmica se representa frente al valor recíproco de la temperatura ( ver Fig. ):
Dependencia de la temperatura del factor de frecuencia
Sin embargo, la ecuación de Arrhenius no se aplica exactamente porque también depende de la temperatura y, a menudo, la ley
sigue. Por lo tanto, el factor preexponencial también aumenta ligeramente al aumentar la temperatura ( función raíz ). Sin embargo, su dependencia de la temperatura es significativamente menor que la del término exponencial. En este caso, se puede utilizar una ecuación de Arrhenius modificada:
Con el exponente combinado para formar el número de Arrhenius
la ecuación de Arrhenius también se representa de la siguiente manera:
Ecuación de Arrhenius en otros procesos
La dependencia de la temperatura de la viscosidad de los líquidos , la densidad del portador de carga con conducción intrínseca en los semiconductores y el coeficiente de difusión en los sólidos también se describe mediante una ecuación de Arrhenius.
Cálculo de la energía de activación
Mediante la medición de dos constantes de velocidad , y dos temperaturas de la misma reacción, la energía de activación se puede calcular mediante la creación de la ecuación de Arrhenius para las dos mediciones de la siguiente manera (suponiendo que A no depende de la temperatura):
Tomando el logaritmo natural e introduciendo un denominador principal se obtiene:
Cambiar después finalmente da como resultado:
Un aumento de temperatura conduce a un aumento en la velocidad de la reacción. Una regla general , la llamada regla de temperatura de velocidad de reacción (regla RGT) , predice que la velocidad de reacción se duplicará a cuatro veces si la temperatura aumenta . El factor por el cual cambia la velocidad de reacción cuando la temperatura aumenta en 10 K se denomina valor Q 10 .
Para una velocidad de reacción multiplicada por dos, se aplica lo siguiente:
y por lo tanto:
Ver también
Evidencia individual
- ^ Jacobus Henricus van't Hoff: Études de dynamique chimique. Frederik Muller & Co., Amsterdam 1884, págs. 114-118.
- ↑ Svante Arrhenius, Z. Phys. Chem. 1889, 4 , págs. 226-248.
- ↑ Entrada sobre la ecuación de Arrhenius . En: Compendio de terminología química de la IUPAC (el “Libro de oro”) . doi : 10.1351 / goldbook.A00446 Versión: 2.3.1.
- ↑ Entrada sobre la ecuación de Arrhenius modificada . En: Compendio de terminología química de la IUPAC (el “Libro de oro”) . doi : 10.1351 / goldbook.M03963 Versión: 2.3.1.
- ^ Charles E. Mortimer, Ulrich Müller, Química - El conocimiento básico de la química, página, 11a edición, ISBN 978-3-13-484311-8 , página 266f
- ↑ M. Binnewies, Allgemeine und Anorganische Chemie, 1ª edición de 2004. ISBN 3-8274-0208-5 , págs. 299 y sig.