fotosíntesis

La fotosíntesis ( griego antiguo φῶς Phos , alemán 'luz' y σύνθεσις Síntesis , alemán , composición ' también escrito fotosíntesis ) es un proceso fisiológico para la producción de biomoléculas ricas en energía a partir de sustancias de menor energía utilizando energía luminosa. Está alimentado por plantas , algas y algunas bacterias . En este proceso bioquímico se utilizan tintes que absorben la luz , como la clorofila , energía luminosa convertida en energía química . Luego, esto se usa para construir compuestos orgánicos ricos en energía (principalmente carbohidratos ) a partir de sustancias inorgánicas de baja energía ( dióxido de carbono (CO 2 ) y agua (H 2 O)). Dado que las sustancias orgánicas ricas en energía se convierten en componentes del ser vivo, su síntesis se denomina asimilación .
Se hace una distinción entre fotosíntesis oxigenada y anoxigénica . En el caso del oxígeno, se genera oxígeno molecular (O 2 ). Anoxigenico, que solo es usado por algunas bacterias, produce otras sustancias inorgánicas en lugar de oxígeno, por ejemplo azufre elemental ( S ).
La fotosíntesis es el único proceso bioquímico en el que la energía luminosa, principalmente energía solar , se convierte en energía unida químicamente. Casi todos los seres vivos heterótrofos (no capaces de realizar la fotosíntesis) dependen indirectamente de él, ya que en última instancia le deben su alimento y el oxígeno necesario para la producción de energía a través de la respiración aeróbica . La capa protectora de ozono también se crea a partir del oxígeno .
La formación de colecalciferol (vitamina D) dependiente de UVB también se conoce como fotosíntesis.
Información general
La fotosíntesis se puede dividir en tres pasos:
- En primer lugar, la energía electromagnética se absorbe en forma de luz de una longitud de onda adecuada mediante colorantes (clorofilas, ficobilinas , carotenoides ).
- Inmediatamente después de esto, en el segundo paso, la energía electromagnética se convierte en energía química mediante la transferencia de electrones , que han sido llevados a un estado de alta energía por la energía de la luz ( reacción redox ) (ver fototrofia ).
- En el paso final esta energía química se utiliza para la síntesis de compuestos orgánicos energéticos en los seres vivos tanto en el metabolismo constructivo para el crecimiento como en el metabolismo energético se utilizan para la recuperación de energía.
Los dos primeros pasos se conocen como reacción de luz y ocurren en plantas en el fotosistema I y el fotosistema II . El último paso es una reacción en gran medida independiente de la luz.
La síntesis de sustancias orgánicas ricas en energía se basa principalmente en el compuesto de carbono dióxido de carbono (CO 2 ). Esto debe reducirse para la recuperación de CO 2 . Los electrones de sustancias oxidables sirven como agentes reductores (reductores, donantes de electrones): agua (H 2 O), elemental, hidrógeno molecular (H 2 ), sulfuro de hidrógeno (H 2 S), iones de hierro divalentes (Fe 2+ ) o simples orgánicos Sustancias (como ácidos y alcoholes , por ejemplo, acetato o etanol ). Además, los electrones también se pueden obtener de la oxidación de carbohidratos simples. El reductor que se utilice depende del organismo, de las enzimas de las que dispone para utilizar los reductores.
| Donación de electrones (en) o | Forma de fotosíntesis | Ocurrencia |
|---|---|---|
| Iones de hierro II (Fe 2+ ) | fotosíntesis anoxigénica | Bacterias moradas |
| Nitrito (NO 2 - ) | fotosíntesis anoxigénica | Bacterias moradas |
| azufre elemental (S 0 ) | fotosíntesis anoxigénica | Bacterias moradas |
| Sulfuro de hidrógeno (H 2 S) | fotosíntesis anoxigénica | bacterias verdes sin azufre , bacterias verdes de azufre , bacterias púrpuras |
| Tiosulfato (S 2 O 3 2− ) | fotosíntesis anoxigénica | Bacterias moradas |
| Agua (H 2 O) | fotosíntesis oxigenada | Cianobacterias , plástidos de los eucariotas fototróficos |
| Hidrógeno (H 2 ) | fotosíntesis anoxigénica | bacterias verdes sin azufre |
Equilibrio fotosintético
En el caso del CO 2 como material de partida, el esquema de reacción general de la fotosíntesis se puede formular de manera general y simplificada con las siguientes ecuaciones de suma, en las que <CH 2 O> representa las sustancias orgánicas ricas en energía formadas.
Con un reductor que se reduce liberando hidrógeno (H), como agua (H 2 O), sulfuro de hidrógeno (H 2 S) e hidrógeno molecular elemental (H 2 ), (todos simbolizados aquí con la expresión general <H>) :
Con un reductor que reduce (e - ) liberando electrones , como iones de hierro divalentes (Fe 2+ ) y nitrito (NO 2 - ):
Algunas bacterias usan compuestos orgánicos como reductores, como el lactato, el anión del ácido láctico :
La reacción general de la fotosíntesis con agua o sulfuro de hidrógeno como reductor también se puede formular mediante la siguiente ecuación general simplificada de suma:
Como formulación general, H 2 A representa el reductor H 2 O o H 2 S.
Todas las algas y plantas terrestres verdes solo usan agua (H 2 O) como reductor de H 2 A. Las cianobacterias también usan principalmente agua como reductor. En este caso, la letra A representa el oxígeno unido al agua (O). Se libera como un producto de oxidación del agua durante la llamada fotosíntesis oxigenada como oxígeno molecular elemental (O 2 ). Todo el oxígeno en la atmósfera y la hidrosfera de la tierra está formado por fotosíntesis oxigénica .
Las bacterias fotosintéticas ( Chloroflexaceae , Chlorobiaceae , Chromatiaceae , Heliobacteria , Chloracidobacterium ) pueden utilizar un espectro mucho mayor de reductores, pero utilizan principalmente sulfuro de hidrógeno (H 2 S). Muchas cianobacterias también pueden usar sulfuro de hidrógeno como reductor. Dado que en este caso A representa el azufre unido al sulfuro de hidrógeno, el azufre elemental (S) y no se libera oxígeno en este tipo de fotosíntesis bacteriana. Por lo tanto, esta forma de fotosíntesis se llama fotosíntesis anoxigénica .
Algunas cianobacterias también pueden usar iones de hierro divalentes como reductores.
Incluso si se utilizan diferentes reductores en la fotosíntesis oxigenada y anoxigénica, ambos procesos tienen en común que los electrones se obtienen a través de su oxidación . Utilizando estos electrones llevados a un alto nivel de energía (bajo potencial redox ) con energía luminosa, se forman los compuestos de alta energía ATP y NADPH , mediante los cuales se pueden sintetizar sustancias orgánicas de alta energía a partir del CO 2 .
El carbono necesario para la síntesis de compuestos orgánicos de alta energía se puede obtener a partir del dióxido de carbono (CO 2 ) o de compuestos orgánicos simples (por ejemplo, acetato). En el primer caso, se habla de fotoautotrofia . La gran mayoría de los organismos fototróficos son fotoautótrofos. Los organismos fotoautótrofos incluyen, por. B. todas las plantas terrestres verdes y algas. En ellos, una triosa fosforilada es el producto de síntesis principal y sirve como material de partida para la construcción posterior de bloques de construcción y materiales de reserva (es decir, varios carbohidratos). Los fotoautótrofos impulsan casi todos los ecosistemas existentes (directa e indirectamente) con su metabolismo de fotosíntesis , ya que proporcionan a otros seres vivos materiales de construcción ricos en energía y fuentes de energía mediante la construcción de compuestos orgánicos a partir de CO 2 inorgánico . Si se utilizan compuestos orgánicos simples como materiales de partida, este proceso, que solo ocurre en bacterias, se denomina fotoheterotrofia .
Historia de la investigación
Desde la antigüedad ( Aristóteles ) prevaleció la idea de que la planta toma su alimento de la tierra. No fue hasta 1671 que Marcello Malpighi sometió este punto de vista a un examen experimental, mediante el cual llegó a la conclusión de que el jugo nutritivo de las hojas es procesado ("hervido") por el poder de la luz solar y solo entonces puede causar crecimiento. Después del descubrimiento del oxígeno en la década de 1770, Jan Ingenhousz demostró en 1779 que se forma en hojas verdes cuando se exponen a la luz. En otra publicación de 1796 afirmó que la planta toma el "ácido carbónico" (dióxido de carbono) que ha absorbido y toma el carbono como alimento y "exhala" el oxígeno.
A pesar de estos hallazgos, la teoría del humus pudo mantenerse hasta mediados del siglo XIX, porque la mayoría de los investigadores estaban convencidos de que los seres vivos solo pueden emerger de los seres vivos. Sólo a través de los éxitos de Justus von Liebig (1840) con los fertilizantes minerales se hizo inevitable que las plantas pudieran asimilar sustancias inorgánicas. En la década de 1860, Julius von Sachs describió que los cloroplastos acumulan almidón en la luz , que se cree que se forma a partir del azúcar como producto principal de la fotosíntesis.
Durante mucho tiempo no quedó claro cómo se produce la asimilación del dióxido de carbono y cómo se relaciona este proceso con la acción de la luz. Además de la suposición de que el dióxido de carbono es dividido fotolíticamente directamente por la clorofila , Frederick Blackman y Gabrielle Matthaei postularon en 1905 que se debía hacer una distinción entre una reacción fotoquímica a la luz y una reacción enzimática oscura. En 1930, Cornelis Bernardus van Niel sugirió, en analogía con sus resultados con bacterias del azufre , que la fotosíntesis fue un intercambio de hidrógeno entre un donante y dióxido de carbono como un aceptor, el agua siendo donante (análoga a H 2 S para las bacterias de azufre ). Robert Hill proporcionó una evidencia impresionante para estas tesis en 1937 cuando informó que los cloroplastos aislados forman oxígeno incluso en ausencia de dióxido de carbono cuando las sales de hierro están presentes como aceptores artificiales de electrones ( reacción de Hill ). En el transcurso de la década de 1950, numerosos investigadores aclararon los detalles de las reacciones de luz y oscuridad.
Absorción de energía luminosa
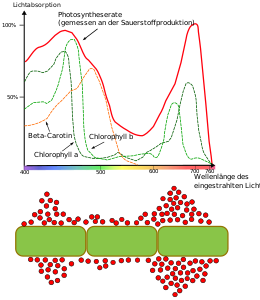
abajo : Experimento de la bacteria Engelmann (gráfico no a escala). El espectro de luz de un prisma se proyectó sobre un talo de hilo de un alga verde ( Oedogonium ). Una cantidad particularmente grande de bacterias aerófilas que nadan activamente (esferas rojas) se acumula en las áreas roja y azul. Debido al efecto protector de los carotenoides en el área azul, el espectro de actividad fotosintética es más pequeño allí que en el área roja.
En los organismos fototróficos, los tintes capturan la energía de la luz. En plantas verdes y cianobacterias es clorofilas , en otras bacterias es bacterioclorofilas. Estos tintes absorben luz de diferentes rangos de longitud de onda . El llamado espacio verde conduce al color verde característico. El rango espectral óptimo para la fotosíntesis se determinó experimentalmente por primera vez mediante el experimento bacteriano de Engelmann . Los tintes que absorben la luz también se denominan cromóforos . Si estos forman complejos con las proteínas circundantes, también se denominan pigmentos .
Cuando la luz incide en un pigmento, el cromóforo cambia a un estado excitado. Dependiendo de cómo se construyan los dobles enlaces conjugados del cromóforo, la energía para tal excitación y por lo tanto el espectro de absorción difieren. En el caso de las clorofilas a y b se producen en las plantas , principalmente luz azul y roja son absorbidos, mientras que la luz verde no es. La clorofila excitada por la luz ahora puede transferir su electrón excitado a otra sustancia, un aceptor de electrones, queda un radical de clorofila cargado positivamente (Chl • + ). El electrón transferido finalmente puede regresar al radical clorofila a través de una cadena de transporte de electrones a través de otros portadores de electrones. De esta forma el electrón transloca protones a través de la membrana ( bomba de protones ), por lo que la energía luminosa se convierte en un potencial eléctrico y osmótico ( acoplamiento quimiosmótico ).
Complejos de recolección de luz

La fotosíntesis usando pigmentos simples sería relativamente ineficiente, ya que estos solo opondrían la luz en un área pequeña y, además, solo absorberían en un rango estrecho de longitudes de onda. Al disponer complejos recolectores de luz que contienen clorofila para formar antenas alrededor de un centro de reacción común, tanto la sección transversal se agranda como el espectro de absorción. Los cromóforos estrechamente espaciados en las antenas transmiten la energía luminosa de un pigmento a otro. Esta cantidad definida ( cuántica ) de energía de excitación también se llama excitón . Los excitones finalmente llegan al centro de reacción en unos pocos picosegundos. La transferencia de excitones presumiblemente tiene lugar dentro de un complejo de captación de luz por electrones deslocalizados y entre complejos de captación de luz individuales sin radiación por el mecanismo de Förster .
En las plantas, los complejos de captación de luz forman una antena central ( núcleo ) y una antena exterior y están incrustados en la membrana tilacoide junto con el centro de reacción . No sólo la clorofila una y b sirven como cromóforos , sino también carotenos y xantofilas . Por un lado, protegen la antena si una molécula de clorofila desarrolla un estado triplete dañino . Por otro lado, estos cromóforos amplían el rango de longitud de onda para capturar la luz.
En las cianobacterias, las antenas se superponen a la membrana tilacoide desde el exterior. Los complejos de antenas se denominan ficobilisomas , cuyas proteínas de ficobilina absorben la luz verde en particular.
Las bacterias verdes de azufre y las bacterias verdes sin azufre utilizan los llamados clorosomas para su fotosíntesis anoxigénica . Se trata de partículas alargadas parecidas a lípidos que se encuentran en el lado citoplasmático de la membrana y están conectadas al centro de reacción fotosintética. Son colectores de luz especialmente eficaces.
Fotosíntesis de oxígeno

Las plantas verdes, las algas y las cianobacterias utilizan la energía de la luz para almacenar energía en forma de trifosfato de adenosina (ATP) y para obtener electrones del agua como agente reductor. El agua (H 2 O) se oxida extrayendo electrones de ella, y en el proceso se liberan oxígeno molecular (O 2 ) y protones (H + ) ( fotólisis del agua). Esta forma de fotosíntesis se llama fotosíntesis oxigenada debido a la liberación de oxígeno ( oxigenio ) . Los electrones obtenidos se transfieren al aceptor final NADP + a través de una serie de portadores de electrones en la membrana tilacoide , que son necesarios en el metabolismo del organismo, especialmente para la acumulación de carbohidratos ("reacción oscura").
- Ecuación parcial de la división del agua por la luz.
Durante este proceso, los protones se transportan simultáneamente al lumen de los tilacoides. El gradiente de protones resultante ΔP (gradiente electroquímico) impulsa la enzima ATP sintasa a través del acoplamiento quimiosmótico , que forma y regenera ATP a partir de ADP y fosfato (fotofosforilación):
- Ecuación parcial de síntesis de ATP, liberación de agua.
El número de moléculas de ATP de 3 ATP por 2 H 2 O indicado anteriormente resulta indirectamente del requerimiento de energía del ciclo de Calvin ("reacción oscura"). No se sabe si en realidad se forman exactamente tres moléculas de ATP a partir de la división de dos moléculas de agua. Para poder oxidar el agua por un lado y poder reducir el NADP + por otro , se conectan en serie dos sistemas fotoeléctricos diferentes , cuyos potenciales redox se modifican por la absorción de luz. El fotosistema II proporciona un agente oxidante fuerte para oxidar el agua, mientras que el fotosistema I genera un agente reductor fuerte para reducir el NADP + . Esta reacción se denomina comúnmente "reacción a la luz", ya que esta parte de la fotosíntesis depende directamente de la luz.
En el balance general, se forma una molécula de oxígeno en la reacción de luz, dos moléculas de NADP se reducen a NADPH y aproximadamente tres moléculas de ADP se fosforilan a ATP:
- Ecuación parcial "reacción a la luz"
O más generalmente para la división de 12 moléculas de agua:
- ecuación parcial simplificada "reacción a la luz", [H] representa un equivalente de reducción
El agente reductor (NADPH) obtenido en la reacción de luz y la fuente de energía (ATP) también obtenida en el proceso se utilizan luego en el llamado ciclo de Calvin ("reacción oscura"), en el que los carbohidratos se forman a partir del dióxido de carbono. El NADPH se utiliza para la reducción de 1,3-bisfosfoglicerato a gliceraldehído-3-fosfato .
- ecuación parcial simplificada "reacción oscura"
El oxígeno liberado no proviene del CO 2 fijo , sino del agua. Por lo tanto, en la primera ecuación de suma a continuación, hay 12 moléculas de agua a la izquierda y 6 moléculas de O 2 a la derecha . En la ecuación general de la fotosíntesis oxigenada, la glucosa (C 6 H 12 O 6 ) sirve como ejemplo, representa el producto primario:
- ecuación de reacción bruta simplificada para la fotosíntesis oxigenada
- ecuación de reacción neta simplificada para la fotosíntesis oxigenada
- La dextrosa ( glucosa ) y el oxígeno se producen a partir del dióxido de carbono y el agua mediante la adición de energía (luz) .
- Ecuación de palabras para la fotosíntesis oxigenada
La fotosíntesis de oxígeno es realizada por cianobacterias y todos los organismos fototróficos eucariotas. Ejemplos de esto son, además de todas las plantas verdes, numerosas algas unicelulares ( protistas ). La importancia de este proceso radica en la producción primaria de sustancias orgánicas, que son utilizadas por los organismos quimioheterótrofos como fuente de energía y materiales de construcción, y en la formación de oxígeno, que es esencial para todos los organismos aeróbicos y que se forma casi en la tierra. exclusivamente a través de la fotosíntesis oxigenada.
Fotofosforilación lineal (no cíclica)
En organismos con fotosíntesis oxigénica, los dos fotosistemas integrados en la membrana II e I están conectados en serie. Similar a la cadena respiratoria, los dos fotosistemas están unidos por una cadena de transporte de electrones que, además de la pequeña molécula de plastoquinona, también incluye un complejo de más de membrana integrado proteína ( citocromo b 6 f complejo ) y la pequeña proteína de plastocianina . Si se grafican los potenciales redox de todos los socios redox involucrados en la reacción, se produce una especie de curva en zigzag, que recuerda a una “Z” rotada (diagrama Z, ver figura).
La energía de excitación requerida para la transferencia de electrones en los centros de reacción de los fotosistemas se absorbe en forma de radiación principalmente por los complejos acumuladora de luz , que además de chlorophyll- una también contienen chlorophyll- b y carotenoides , que absorben en una amplia rango del espectro de longitud de onda visible (ver espectro anterior ). Cuando se absorbe un cuanto de luz roja, la molécula cambia al estado de energía excitada S 1 , cuando un cuanto de luz azul se absorbe en el estado S 2 con mayor energía. Solo el estado S 1 puede usarse para fotoquímica. Sin embargo, al liberar el exceso de energía en forma de calor (conversión interna) , es posible cambiar del nivel S 2 al S 1 , lo que también hace utilizables los cuantos de luz de mayor energía.
A través de la transferencia de energía sin radiación , la energía de los estados excitados se puede transferir entre moléculas de clorofila vecinas a los centros de reacción de los fotosistemas. El retroceso al nivel inicial S 0 tiene lugar con la liberación de energía, dependiendo el tipo de liberación de la eficiencia del proceso respectivo.
Con un rendimiento cuántico de aproximadamente 85% de la energía de excitación, una separación de la carga se realiza en los centros de reacción abiertos del fotosistema II, en el que un electrón es transferido de la clorofila emparejado a moléculas ( par especial , P680 ) a un aceptor primaria , se transfiere una subunidad de feofitina (Phe) D1. Desde allí, pasa a través de la plastoquinona Q A (subunidad D2) unida firmemente a una plastoquinona (Q B ) unida débilmente (subunidad D1). Después de la absorción de dos electrones y la protonación por H + del estroma , Q B se libera como plastoquinol ( también plastohidroquinol, PQH 2 ) en la matriz de la membrana, en la que puede difundirse libremente. Una tercera plastoquinona (Q C ) recientemente descubierta media el intercambio de Q B con el grupo de quinonas de la membrana.
El radical P680 • + oxidado restante , que es un agente oxidante muy fuerte con un potencial redox de más de +1 V, se reduce mediante un residuo de tirosina (Tyr z ). Este, a su vez, es regenerado por el grupo de manganeso del complejo de separación de agua .
PQH 2 se difunde en la membrana tilacoide al complejo citocromo b 6 f . El complejo juega un papel central en la cadena de transporte de electrones y media dos transiciones de electrones sucesivas. El primer electrón es extraído del PQH 2 por la proteína Rieske , una proteína 2-hierro-2-azufre . Esta proteína debe su nombre al descubridor John S. Rieske , quien aisló la proteína con sus colegas en 1964. La proteína de Rieske pasa el electrón al citocromo f de la subunidad del citocromo f. El citocromo f, a su vez, dona un electrón a una plastocianina . Cuando se recoge el electrón, la plastocianina se encuentra en el lado del complejo del citocromo b6f que mira hacia la luz.
La segunda transferencia de electrones se lleva a cabo a través de la membrana integral b subunidad de la citocromo b 6 complejo que contiene dos citocromos de la b tipo. Estos transfieren el segundo electrón del radical de semiquinona PQH • - a una plastoquinona, que es protonada por H + del estroma (ciclo Q). La reoxidación de PQH 2 en el complejo del citocromo b 6 f es el paso más lento y, por lo tanto, limitante de la velocidad de la cadena de transporte de electrones con una duración de aproximadamente 5 ms. Esto probablemente se deba al cambio necesario en la conformación de la proteína de Rieske y la difusión restringida de PQH 2 al centro activo del complejo, que se encuentra en un bolsillo profundamente hundido.
En resumen, PQH 2 se reoxida a PQ, se recicla un electrón en el ciclo Q y finalmente se transfiere un electrón a la proteína plastocianina (PC), que puede aceptar un electrón. Durante esta transferencia, se transloca un protón por electrón desde el estroma de los cloroplastos al lumen tilacoide.
La plastocianina es una proteína soluble en agua que contiene cobre, cuyo átomo de cobre cambia entre los estados de oxidación Cu I y Cu II y, por lo tanto, puede aceptar y liberar un electrón. Se difunde en la luz del tilacoide. En cuanto a su función, es similar al citocromo c en la cadena respiratoria. En algunas cianobacterias y algas, la plastocianina se reemplaza por la variante del citocromo c 6 .
La plastocianina reducida liberada por el complejo Cyt b 6 f finalmente alcanza el complejo fotosistema I (PS I). También PS I contiene un par molécula de clorofila y tiene un máximo de absorción a alrededor de 700 nm y un potencial redox E ' 0 = + 0,45 V. Como P680 en PS II, la chlorophyll- un par en el centro de reacción se pone en un energéticamente más alto estado (E ' 0 = −1,3 V) y libera un electrón. Esto crea un radical de clorofila positivo (Chl-a • + ), que acepta un electrón de la plastocianina acoplada y, por lo tanto, se reduce a Chl- a . Después de liberar el electrón, el complejo Cyt- b 6 f puede reducir de nuevo la PC .
El electrón que fue cedido por la clorofila, una molécula, primero golpea un primer aceptor, A 0 . Se supone que se trata de una clorofila especial. Este es un agente reductor inusualmente fuerte y reduce un firmemente unido filoquinona (Q, también A 1 ). Desde allí, el electrón se transfiere a un centro de hierro-azufre (F x ) y finalmente llega a la ferredoxina (Fd) a través de otros centros de hierro-azufre (F A , F B ). Se encuentra en el lado estromal de la membrana tilacoide. El Fd reducido se une a una ferredoxina-NADP reductasa y reduce NADP + a NADPH.
El transporte de electrones está acoplado a una translocación de protones desde el estroma al lumen. Por cada electrón transferido completamente del agua al NADPH, se trasladan tres protones al lumen. Esto crea una diferencia de concentración de protones (ΔpH), así como un campo eléctrico a través de la membrana tilacoide, que en total se denomina fuerza motora de protones Δμ H + ( fuerza motriz del protón ). Según la teoría quimiosmótica de Peter Mitchell, la ATP sintasa utiliza la fuerza motora del protón para generar tres ATP a partir de ADP y fosfato inorgánico con la ayuda de 14 protones . Este proceso también se llama fotofosforilación . En el balance, se transportan tres protones por electrón debido al transporte lineal de electrones, teniendo en cuenta el ciclo Q. Dado que no se requieren 14 protones para generar tres ATP, ATP y NADPH no se generan en una proporción de 3: 2 = 1,5, sino en una proporción fija de 9: 7 = 1,3.
Complejo productor de oxígeno

La brecha electrónica del radical clorofila en el centro de reacción de PS II aún no se ha cerrado. Aquí los electrones se obtienen del agua (E ' 0 = + 0.82 V). Un residuo de tirosina de la subunidad D1 (Tyr161 = Tyr Z ) y un grupo de manganeso están involucrados en esta " división del agua ". El radical Chl a retira un electrón del residuo reactivo de tirosina, lo que significa que él mismo se oxida a un radical tirosina. Para que el radical tirosina se reduzca nuevamente, necesita un electrón de un complejo metálico especial , el grupo de manganeso-calcio. El grupo de manganeso-calcio (Mn 4 CaO 5 ) es el componente más importante del complejo productor de oxígeno (" complejo generador de oxígeno ", OEC). El grupo se compone esencialmente de cuatro átomos de manganeso, un átomo de calcio y un átomo de cloro periférico . Esta composición inusual de cinco átomos de metal es extremadamente rara. Solo se conoce un ejemplo de CO monohidrogenasa en el que otros átomos de metal ( Fe , Ni ) tienen una composición similar a través de puentes de azufre . Funcionalmente, el átomo de calcio se puede reemplazar por un átomo de estroncio y el átomo de cloro esencial por un átomo de bromo .
A pesar de estudios intensivos, la geometría exacta de los átomos metálicos aún no se ha aclarado por completo. Los átomos de metal con átomos de oxígeno pueden estar presentes como se muestra en la figura de la derecha y forman complejos con varios aminoácidos de la subunidad D1 o CP43 . Todos los átomos de manganeso están coordinados por seis moléculas y dos moléculas de agua se unen al átomo de manganeso número 4 (Mn4).
El clúster Mn 4 CaO 5 funciona como una especie de batería . Gradualmente, tres iones de manganeso emiten un electrón cada uno y cambian entre los estados de oxidación de Mn III y Mn IV (ver figura). Como resultado, se pueden lograr diferentes estados de oxidación del grupo (S 0 a S 4 ). Sin embargo, dado que los electrones del grupo están fuertemente deslocalizados , es difícil establecer el estado de oxidación exacto de los átomos de manganeso. Se ha discutido que el cuarto átomo de manganeso en el estado S 4 alcanza un estado formal de oxidación de V. Sin embargo, es más probable que se forme un radical oxo (ver figura). En 2014, con la ayuda de una aplicación especial de rayos X - láseres de electrones libres de rayos X (serie de femtosegundo estructura de rayos X de análisis), los científicos fueron capaces de grabar imágenes de los diferentes estados excitados del fotosistema II. El estado exacto de oxidación aún no se ha aclarado claramente (a partir de 2014). Se postula que el átomo de oxígeno nº 5 (O5) no está presente como oxo ligando (O 2 - ), sino como molécula de agua durante el estado S 0 y como ión hidróxido (OH - ) durante el estado S 1 . Además, debería ser una de las dos moléculas de agua que se utilizan para formar oxígeno en el curso de la división del agua.
Solo cuando se han transferido cuatro electrones al Tyr Z (S 4 ), se forma y libera oxígeno y se alcanza de nuevo el estado reducido (S 0 ). Este ciclo también se conoce como el "ciclo Kok". Se requieren un total de cuatro excitones para liberar una molécula de oxígeno, como han demostrado los estudios de Pierre Joliot y Bessel Kok .
Se cree que oxidar gradualmente el agua liberaría muchas especies reactivas de oxígeno (ROS). Con el mecanismo descrito anteriormente, este riesgo se minimiza. Sin embargo, lo especial de esta enzima no es el hecho de que libera oxígeno (las catalasas también podrían hacer esto), sino que forma un enlace O - O entre dos moléculas de agua.
Fotofosforilación cíclica
El transporte cíclico de electrones en la reacción de luz se lleva a cabo solamente en el fotosistema I . Los electrones de la ferredoxina no pasan a la NADP + reductasa como en el transporte de electrones no cíclico habitual (véase más arriba), sino que se devuelven al complejo citocromo b 6 f . Desde allí, los electrones regresan al fotosistema I y finalmente llenan el espacio de electrones en el centro de reacción. Aunque no se forma NADPH en el proceso, se genera una fuerza motora de protones, que se utiliza para producir ATP. Dado que se trata de un ciclo, este proceso también se denomina fotofosforilación cíclica .
Las plantas C 4 tienen una mayor necesidad de ATP y, por tanto, podrían utilizar la fotofosforilación cíclica de forma más intensa que las plantas C 3 . Pero estos últimos también dependen de la fotofosforilación cíclica para cubrir estequiométricamente los requisitos de NADPH y ATP para el ciclo de Calvin (incluida la fotorrespiración).
Transporte de electrones pseudocíclico
En el transporte de electrones no cíclico, la ferredoxina (Fd) cede su electrón en NADP + , por lo que se forma NADPH. Debido al alto grado de reducción, también existe la posibilidad de que el electrón se transfiera al oxígeno (O 2 ). El radical superóxido se crea en la llamada reacción de Mehler . Lleva el nombre del trabajo de Alan H. Mehler:
Este radical pertenece a las especies de oxígeno altamente reactivas (ROS) y puede dañar proteínas, membranas y ADN. Por lo tanto, primero se hace reaccionar con una superóxido dismutasa ( EC 1.15.1.1 ) a oxígeno y peróxido de hidrógeno (H 2 O 2 ) desproporcionado . La reacción también puede tener lugar de forma espontánea:
El peróxido de hidrógeno también es un ROS y se vuelve inofensivo por una peroxidasa ascorbato ( EC 1.11.1.11 ) presente en las membranas tilacoides . Durante este proceso de desintoxicación, el ascorbato se oxida a monodehidroascorbato, mientras que el H 2 O 2 se reduce a agua. La presencia de ferredoxina regenera el monodehidroascorbato de nuevo a ascorbato. El equilibrio resulta así:
y así en general:
Normalmente, se liberan cuatro electrones del agua que se divide en PS II y se transfieren a la ferredoxina. Estos se utilizan ahora en el curso de la reacción de Mehler para formar agua, por lo que se habla de un transporte de electrones pseudocíclico . Como en el transporte cíclico de electrones, los electrones no se transfieren a NADP + . Este ciclo fue en la literatura como ciclo de agua-agua ( ciclo de agua-agua de aquí en adelante): Una molécula de agua se divide y posteriormente genera otro nuevo. En el balance general, la división del agua de PS II se invierte formalmente y no se acumulan equivalentes de reducción.
La reacción de Mehler ocurre v. una. luego, cuando hay mucho NADPH reducido y, por tanto, también mucha ferredoxina reducida. En el caso del transporte de electrones pseudocíclico, como en el cíclico, solo se genera un gradiente de protones en el ciclo Q, por lo que se genera ATP. Sin embargo, en estas condiciones, normalmente no hay ADP para acumular ATP, por lo que solo se produce un alto gradiente de protones. El exceso de energía de excitación se puede convertir fácilmente en calor. Posiblemente esto sirva como una "válvula de desbordamiento" bajo altas intensidades de luz y protege el fotosistema II no solo en las plantas, sino también en todas las algas y cianobacterias fotosintéticamente activas. Sin embargo, esto supone que hay suficiente ascorbato presente.
Sin embargo, dos moléculas de monodehidroascorbato también pueden desproporcionarse en ascorbato y deshidroascorbato . Para regenerar el deshidroascorbato, se oxida el glutatión , que a su vez es reducido por una glutatión reductasa ( EC 1.8.1.7 ). Esto consume NADPH. Formalmente, sin embargo, esto no cambia nada en el equilibrio general descrito anteriormente.
Regulación del transporte de electrones en la fotosíntesis oxigenada.
Si los electrones o los estados excitados se transfieren al oxígeno de manera descontrolada, se pueden producir daños en el aparato fotosintético, los sistemas de membranas y las proteínas. Por lo tanto, la regulación del transporte de electrones es extremadamente importante. Por último, pero no menos importante, también debe adaptarse a las necesidades de NADPH y ATP de la planta. Los mecanismos reguladores a largo plazo que tienen lugar a nivel transcripcional no se discuten en esta sección, pero definitivamente tienen lugar.
Distribución lateral desigual de los complejos fotosintéticos en la membrana tilacoide

1: envoltura exterior
2: espacio intermembrana
3: membrana de envoltura interior (1 + 2 + 3: vaina)
4: estroma (matriz)
5: luz tilacoide (dentro del tilacoide)
6: membrana tilacoide
7: Granum (hoja de Grana)
8: tilacoide (Stromalamelle)
9: Cuerpo de almidón
10: ribosoma de plastidio ( plastoribosoma )
11: ADN de plastidio ( ADNc )
12: plastoglobulus (estructura esférica formada por lípidos; pl.: plastoglobuli)
Los complejos de fotosíntesis Photosystem II PS II, Cytochrome b 6 f y Photosystem I PS I están incrustados en la membrana tilacoide. Sin embargo, los fotosistemas no se distribuyen de manera uniforme lateralmente. Debido a su interacción con los complejos de captación de luz, PS II se encuentra en las áreas apiladas del tilacoide ( laminillas granales ); el lado estromal de PS I debe ser de libre acceso para la reducción de NADP + y, por lo tanto, se encuentra en áreas expuestas a la estroma. Estos incluyen áreas no apiladas (laminillas estromales, No. 8 en la figura de la derecha), así como las áreas de borde de la pila de grana ( márgenes y membranas terminales ). La ATP sintasa también necesita espacio en el lado del estroma de la membrana y, por lo tanto, solo se puede encontrar en estas áreas.
La separación espacial de los dos fotosistemas también debería evitar el desbordamiento incontrolado ( desbordamiento ) de los excitones del PS-II al complejo PS-I. Mientras que los excitones fluyen desde las antenas hacia el PS I de una manera altamente eficiente ( trampa de embudo ), la energía de excitación puede incluso saltar fuera de la PS II nuevamente ( trampa poco profunda ). Por lo tanto, si los dos complejos de fotosíntesis estuvieran en proximidad directa, los excitones se agregarían más a menudo a PS I a expensas de PS II.
Redistribución de los complejos colectores de luz LHC-II ( transiciones de estado )
En determinadas circunstancias, los fotosistemas pueden excitarse en diferentes grados porque tienen diferentes espectros de absorción. La planta percibe este estado a través del estado redox del conjunto de plastoquinona.
- Con poca luz, cuando los dos fotosistemas aún no están funcionando a su límite de capacidad, el fotosistema I PS I se estimula con más fuerza que el fotosistema II PS II. Por lo tanto, hay una redistribución de los complejos recolectores de luz LHC-II de PS I a PS II, alrededor de la estimulación desigual para contrarrestar. Esto estimula PS II con más fuerza.
- Si, por el contrario, la PS II se estimula con más fuerza que la PS I, el plastoquinol reducido se acumula en la membrana tilacoide. Una proteína quinasa es activada por el cambio de estado redox del conjunto de plastoquinonas . Como resultado, los complejos LHC-II se fosforilan y migran de PS II a PS I. Esto significa que se prefiere PS I para la excitación de luz.
La redistribución de los LHC se denomina transiciones de estado : si todos los LHC-II están asociados con PS II, el estado 1 está presente. Sin embargo, si están asociados con PS I, el estado 2 está presente ( estado 2 ).
Disipación térmica del exceso de energía.
En determinadas circunstancias, se producen más NADPH y ATP de los que puede consumir la reacción oscura. Este puede ser el caso, por ejemplo, con alta intensidad de luz, o con altas temperaturas o estrés por sequía , cuando los estomas se cierran para reducir la pérdida de agua. Esto también reduce la absorción de CO 2 , por lo que la reacción oscura está limitada y ralentizada por la concentración de CO 2 . A bajas temperaturas, la actividad enzimática del metabolismo en particular se ralentiza, pero las transferencias de electrones en la reacción de luz apenas son, por lo que se produce un exceso de ATP y NADPH. Dado que la cadena de transporte de electrones no tiene un aceptor para los electrones disponibles en estos casos , aumenta la probabilidad de formación de especies reactivas de oxígeno (ROS), que pueden dañar el aparato fotosintético y la célula.
Para disipar el exceso de energía, la zeaxantina entra en acción como parte del ciclo de las xantofilas . Aquí, la zeaxantina se une a una subunidad del complejo LHC-II y puede absorber la energía de las moléculas de clorofila excitadas y liberarla en forma de calor. Aproximadamente el 50-70% de todos los fotones absorbidos se convierten en calor de esta manera. La diatoxantina se usa en un ciclo similar en lugar de la zeaxantina para las diatomeas .
Además de las reacciones antes mencionadas, especialmente en el caso de estrés por sequía, la reasimilación del CO 2 liberado por la fotorrespiración también contribuye a la eliminación del exceso de energía lumínica ; sin embargo, la proporción de los procesos individuales en el consumo de energía lumínica varía en función del tejido foliar (empalizada o parénquima esponjoso) examinado Especie vegetal y tipo de metabolismo ( planta C 3 o C 4 ).
Fotosíntesis anoxigénica
Muchas bacterias fototróficas realizan la fotosíntesis anoxigénica. Se trata de un solo fotosistema, ya sea uno con un centro de reacción de planta tipo I (PS I) o tipo II (PS II). A diferencia de las cianobacterias y eucariotas fototróficas , los centros de reacción contienen clorofilas de bacterias . Al igual que con la fotosíntesis oxigénica, este par de clorofila ( par especial ) es estimulado por la energía de la luz, por lo que su potencial redox cae bruscamente. Como resultado, el par de bacterioclorofila excitado entrega su electrón a un aceptor primario. Dependiendo del centro de reacción, el primer aceptor de electrones estable es una proteína de hierro-azufre (PS I) o una quinona (PS II). Desde allí, finalmente se devuelve al centro de reacción a través de un ciclo Q (transporte cíclico de electrones). Durante este proceso, se genera una diferencia de concentración de protones, a través de la cual se opera una ATPasa . Dado que el ATP se acumula pero no es un agente reductor , este último debe formarse a partir de donantes de electrones externos (compuestos inorgánicos u orgánicos).
Además de este transporte cíclico de electrones, existe también uno no cíclico, a través del cual se forman directamente agentes reductores. Para llenar el espacio de electrones resultante, se utilizan donantes de electrones externos, por ejemplo, H 2 S, iones de hierro divalentes (Fe 2+ ) o nitrito (NO 2 - ) Esto convierte azufre elemental (S), ion de hierro trivalente (Fe 3+ ) o nitrato (NO 3 - ) como productos de reacción.
El potencial redox de la bacterioclorofila pigmento es insuficiente para la disociación del agua. Por consiguiente, no existe un complejo de disociación de agua (véase más arriba). Por lo tanto, el agua no puede usarse como fuente de electrones en la fotosíntesis anoxigénica y, por lo tanto, no se puede producir oxígeno molecular.
Fotosíntesis anoxigénica tipo II
Bacterias verdes no del azufre (Chloroflexi) y púrpura bacterias (púrpura bacterias de azufre y bacterias púrpuras libres de azufre) utiliza un centro de reacción de tipo II para anoxigénica fotosíntesis. El máximo de absorción de bacterioclorofila a o b en el centro es de 870 nm Standard potencial redox E ' 0 cae bruscamente de +0,6 V a −0,8 V. Dona su electrón a una bacteriofeofitina . Desde allí, finalmente llega a una quinona asociada (Q B , E ' 0 = + 0.0 V) a través de una menaquinona firmemente unida (Q A ). Si este se reduce a quinol por dos electrones, abandona el complejo PS II y se difunde en la membrana a un complejo de citocromo bc 1 . Durante el ciclo Q, los electrones se transfieren a este complejo, se forma un gradiente de protones (Δμ H + ). Esto opera una ATPasa, mediante la cual se forma ATP. A partir de ahí, el electrón en el complejo del citocromo bc 1 alcanza un citocromo c (cyt c 2 ), que se difunde de regreso al centro de reacción en el citoplasma de una manera asociada a la membrana. Allí, la brecha de electrones se cierra por oxidación de Cyt c 2 , puede comenzar un nuevo transporte cíclico de electrones.
Para formar agentes reductores, las bacterias púrpuras sin azufre ( Rhodospirillum , Rhodobacter ) y las bacterias verdes sin azufre (por ejemplo, Chloroflexus ) oxidan preferentemente compuestos orgánicos; generalmente crecen con él fotoorganotrófico. La mayoría de las bacterias fototróficas anoxigénicas también pueden fijar (CO 2 ) si utilizan donantes de electrones inorgánicos como el hidrógeno (H 2 ) o (H 2 S), por lo que a menudo son fotolitoautótrofas facultativas.
La quinona también puede transferir sus electrones a NAD (P) + en un transporte de electrones no cíclico , que cataliza una NADH quinona oxidorreductasa. Sin embargo, el potencial redox de la quinona es demasiado alto para reducir directamente NAD (P) + (E ' 0 = −0,32 V). Por lo tanto, para este transporte de electrones invertido (retrógrado), la energía se aprovecha en la forma de la fuerza del motor de protones Δμ H + . Dado que el electrón se eliminó del ciclo, la bacterioclorofila a permanece inicialmente en el centro de reacción como un radical cargado positivamente. Para llenar este vacío, se utilizan electrones de fuentes externas. Las bacterias de azufre púrpura (por ejemplo , Chromatium , Ectothiorhodospira ) oxidan el H 2 S a azufre, que se deposita intra o extracelularmente.
En Rhodopseudomonas viridis , una bacteria púrpura, se conoce la cinética de la transferencia de electrones. Después de la excitación del par de bacterioclorofilas, el electrón alcanza la bacteriofeofitina después de 3 ps. Desde allí se transfiere a la menaquinona Q A después de 200 ps y desde allí llega a la ubiquinona Q B relativamente lentamente (6 µs) . El espacio de electrones en el par de bacterioclorofila del centro de reacción se cierra mediante el citocromo c 2 después de 0,27 µs.
Fotosíntesis anoxigénica tipo I
Las bacterias verdes de azufre (p. Ej., Clorobium ) o Heliobacteriaceae ( Heliobacterium ) tienen un centro de reacción de tipo I. La primera tiene una bacterioclorofila a con un máximo de absorción de 840 nm y las heliobacterias una bacterioclorofila g con 798 nm. En el transporte cíclico de electrones, la bacterioclorofila a (E ' 0 = + 0,3 V) alcanza un estado energético superior (E' 0 = −1,2 V) tras ser excitada por la luz y libera su electrón a otra bacterioclorofila. Desde allí llega a la ferredoxina (Fd) a través de una menaquinona firmemente unida y varios centros de hierro-azufre (F x , F A / F B , E ' 0 = −0,5 V). Fd dona su electrón a la menaquinona ubicada en la membrana, que se alimenta a un ciclo Q. Aquí, se acumula una diferencia en la concentración de protones en la membrana. Finalmente, una unidad de tetracitocromo (Cyt c 553 ) se reduce a través de un complejo Cyt bc 1 , que vuelve a PS I para cerrar la brecha de electrones en el centro de reacción.
Aquí también existe la posibilidad de un transporte de electrones no cíclico: cuando los electrones se transfieren desde el centro de hierro-azufre a una ferredoxina , pasan de allí a NAD (P) + . Esto cataliza una ferredoxina-NADP + oxidorreductasa. Dado que el potencial redox de Fd es menor que el de NAD (P) + , esta reacción puede tener lugar sin ningún gasto de energía. Para llenar el espacio de electrones creado en la bacterioclorofila en el transporte de electrones no cíclico, las bacterias verdes de azufre, por ejemplo, oxidan el H 2 S a azufre.
En el caso de las heliobacterias, no se conoce una forma de fijar el CO 2 . No tienen RuBisCO o ATP citrato liasa (para el ciclo reductor del ácido cítrico ), pero fermentan compuestos orgánicos como piruvato , lactato , butirato y acetato . Algunas cepas también pueden crecer con azúcares y con etanol. Esto significa que crecen heterotróficamente .
Fotosíntesis anoxigénica en las profundidades marinas
La mayoría de los organismos fotosintéticamente activos utilizan la radiación solar incidente como energía luminosa, razón por la cual la fotosíntesis tiene lugar principalmente en la superficie de la tierra. Una bacteria de azufre verde que realiza la fotosíntesis anoxigénica con sulfuro de hidrógeno o azufre como reductor fue descubierta en un ahumador negro a unos 2.500 metros de profundidad en la cordillera del Pacífico Oriental . A esta profundidad, la luz solar no puede alcanzar las bacterias. Sus clorosomas extremadamente sensibles a la luz pueden absorber la débil radiación infrarroja de la fuente hidrotermal y hacerla utilizable para la fotosíntesis.
Asimilación de dióxido de carbono
Los equivalentes de reducción y el ATP obtenidos en la reacción ligera se utilizan para acumular carbohidratos. Por lo tanto, los procesos que tienen lugar en este proceso también se conocen como la reacción secundaria de la fotosíntesis . Dado que no dependen directamente de la luz, también se conocen como reacción oscura . Sin embargo, esta designación es engañosa. Corresponde al hecho de que los procesos tienen lugar por separado de la "reacción luminosa" de la fotosíntesis y no requieren ninguna luz per se . Sin embargo, dado que necesitan ATP y NADPH de la reacción a la luz, la reacción en la oscuridad no tiene lugar en la oscuridad y depende al menos indirectamente de la luz. Además, algunas de las enzimas implicadas solo son activas a la luz.
Hay varias opciones para la asimilación de dióxido de carbono:
ciclo de Calvin
Todos los organismos con fotosíntesis oxigénica así como algunos microorganismos con fotosíntesis anoxigénica (bacterias violetas) pueden fijar dióxido de carbono en el llamado ciclo de Calvin . Como característica esencial, el CO 2 se condensa en ribulosa-1,5-bisfosfato (RubP), que es catalizada por la enzima ribulosa-1,5-bisfosfato carboxilasa / oxigenasa ( RuBisCO ). El gliceraldehído-3-fosfato (G3P) se acumula a través de las siguientes reducciones al consumir NADPH y ATP. En las plantas, las reacciones tienen lugar en el estroma de los cloroplastos . Las enzimas involucradas en este proceso no son sensibles al oxígeno. Sin embargo, RuBisCO tiende a utilizar oxígeno en lugar de dióxido de carbono ( fotorrespiración ), lo que reduce la eficiencia de la fijación de dióxido de carbono.
Hay tres formas diferentes de fijar el dióxido de carbono. La mayoría de las plantas pertenecen al tipo de plantas C 3 , cuyo primer producto intermedio detectable (G3P) contiene tres átomos de carbono. Las plantas C 4 se han adaptado anatómicamente y en términos de su tipo metabólico a la fuerte radiación solar y son más productivas en esta área. Tienen una pre-fijación de CO 2 espacialmente separada . Las plantas CAM , por otro lado, pueden separar temporalmente la fijación primaria de CO 2 de la fotosíntesis real y, si hay falta de agua, solo abren sus estomas por la noche y almacenan el dióxido de carbono absorbido en forma de ácido málico . Después del amanecer, cierran los estomas, liberan el dióxido de carbono del ácido málico y lo introducen en el ciclo de Calvin.
Ciclo reductor del ácido cítrico
En el curso de la fotosíntesis anoxigénica en bacterias verdes de azufre o bacterias verdes sin azufre, el CO 2 es asimilado por el ciclo reductor del ácido cítrico o el ciclo del hidroxipropionato .
Heliobacterias
Las heliobacterias son solo fotoheterótrofas y no fotoautótrofas porque no crecen con CO 2 como única fuente de carbono, sino que requieren fuentes de carbono orgánico como los productos de fermentación. Pero aún puede asimilar CO 2 a través de varias reacciones anapleróticas de un ciclo de ácido cítrico reductor incompleto . Obtienen el agente reductor y el ATP necesarios para ello a través de un fotosistema anoxigénico de tipo I.
Balance de energía
Existen varios parámetros para cuantificar el efecto de la fotosíntesis en relación con la energía utilizada.
La eficiencia es la relación entre el aumento del contenido de energía durante la síntesis del producto fotosintético y la energía luminosa utilizada para la fotosíntesis, por lo que es un cociente adimensional (0-1 o 0-100%). Otros parámetros para el producto de la fotosíntesis (por ejemplo, masa o cantidad de sustancia) también pueden estar relacionados con el gasto de energía. Las cantidades obtenidas se denominan efectividad , cuya unidad corresponde a la cantidad seleccionada para el producto fotosintético (por ejemplo, gramos por julio o moles por julio).
Si se va a representar el efecto principal de la fotosíntesis de un cloroplasto o un microorganismo, el contenido de energía (unidad de medida joule), la masa (unidad de medida gramo) o la cantidad de sustancia (unidad de medida mol) de uno de los Se utilizan los primeros productos de síntesis, normalmente glucosa. Por consideraciones de una planta completa, una comunidad vegetal , una población de microorganismos o por consideraciones globales, es ventajoso utilizar la masa de la biomasa seca total formada (o el carbono contenido en ella).
Cuando se trata de la cuestión de qué contenido energético tiene la luz disponible, existen varios puntos de partida. O se tiene en cuenta la energía de todo el espectro de radiación del sol. O solo la parte del espectro que se puede usar para la fotosíntesis en principio se usa para los cálculos. Esta parte de la radiación representa la radiación utilizable fotosintéticamente (en inglés "radiación fotosintéticamente activa", abreviatura "PAR"). Dependiendo del rango de longitud de onda asumido, la energía del PAR es del 40 al 50 por ciento de la de la irradiación total. En el caso de plantas y algas, según el autor, se asume el rango de longitud de onda de 360 a 720 nm, en parte de 360 a 700 nm y en parte de 400 a 700 nm.
La eficiencia teórica de la fotosíntesis resulta de la relación entre la energía química obtenida y la energía absorbida de la radiación electromagnética :
Balance energético en plantas y otros organismos con fotosíntesis oxigenada
Eficiencia
Para acumular 1 mol de carbohidrato D- glucosa a partir de 6 moles de CO 2 en el ciclo de Calvin , se requieren 2872 kJ en condiciones estándar:
La energía requerida es proporcionada por NADPH + H + y ATP, que se crean en la reacción primaria por la luz.
Por fotólisis del agua, se forman 2 moles de NADPH + H + por mol de O 2 . La cantidad de ATP formada por mol de O 2 depende del ciclo Q y es de 2 moles sin el ciclo Q y de 3 moles con un ciclo Q completo. Los moles de ATP están disponibles en la reacción secundaria.
La entalpía de formación libre molar estándar para NADPH + H + es:
La entalpía de formación libre molar estándar para ATP a partir de ADP + P i es:
Por tanto, el rendimiento de la reacción de luz endergónica por mol de O 2 está entre:
Ambos y están por encima de la entalpía molar de formación estándar para la fijación de CO 2 de 2872 kJ / mol.
En la reacción de luz endergónica, se deben absorber 4 excitones como energía de excitación en cada uno de los dos fotosistemas, es decir , al menos 4 moles de fotones con una longitud de onda de 680 nm en PS II y al menos tantos con una longitud de onda de 700 nm en PS I. La energía de los fotones asciende a:
Sin embargo, se determinó experimentalmente un requisito de 9 a 10 fotones sobre la base del rendimiento cuántico . Dado que se dividen 6 moles de agua para formar 1 mol de glucosa, la energía electromagnética absorbida se encuentra entre:
Esto da como resultado valores entre:
Dado que no solo los fotones de la parte roja del espectro se irradian en un entorno natural, es decir, a la luz del sol, la eficiencia real (bruta) es de un máximo del 20%.
Producción primaria neta
La efectividad de la fotosíntesis en relación con la cantidad total de luz solar que cae sobre la tierra se puede establecer de la siguiente manera:
| Irradiación total | 100% |
| La mitad se absorbe, el resto se deja pasar o se refleja en la hoja. | 50% |
| 3,2% de esta en producción primaria bruta, el resto convertido en calor | 1,6% |
| La mitad de esto como producción primaria neta, la otra mitad se consume en la respiración. | 0,8% |
Por lo tanto, la planta utiliza solo una pequeña parte de la energía solar incidente para convertir el dióxido de carbono en material celular en la producción primaria neta. Dado que parte de la energía se utiliza para mantener el metabolismo, la eficiencia (bruta) del 20% estimada anteriormente se reduce aún más. Por lo tanto, la eficiencia (neta) cae a un máximo de 1 a 2%, dependiendo de las condiciones ambientales predominantes.
La producción primaria neta anual total se estima en 1,54 · 10 11 toneladas de biomasa vegetal (materia seca).
Una hectárea de bosque caducifolio produce alrededor de 12 toneladas de materia orgánica por año en producción primaria neta. Esta biomasa corresponde a un contenido energético de 230 · 10 9 julios.
Sin embargo, la efectividad real en condiciones de campo es menor por varias razones, incluidos los niveles de dióxido de carbono subóptimos.
Dependencia de factores abióticos
La fotosíntesis depende de una serie de factores abióticos que también se influyen entre sí. Se aplica la ley del mínimo : la fotosíntesis está restringida por el recurso relativamente escaso. Para cuantificar la fotosíntesis, se puede definir la denominada tasa de fotosíntesis. Se mide como la cantidad de oxígeno o glucosa producida por unidad de tiempo. También se puede especificar como la absorción de CO 2 por unidad de tiempo.
El crecimiento y el rendimiento en plantas cultivadas se incrementan teniendo en cuenta los factores que se mencionan a continuación en cultivos de invernadero .
dióxido de carbono
Dado que el dióxido de carbono se fija en la fotosíntesis, depende de una concentración de CO 2 suficientemente alta . En la atmósfera terrestre actual (2019), la concentración de CO 2 es 0.041% por volumen (% por volumen). A temperatura ambiente, 1 m³ de aire contiene de 14 a 19 mmol de CO 2 .

La tasa de fotosíntesis de las plantas C 3 aumenta al aumentar la concentración de CO 2 en el aire (ver figura a la derecha). Sólo cuando la concentración de CO 2 es suficientemente alta supera la tasa de fotosíntesis de las plantas C 4 . En condiciones atmosféricas (0,04% en volumen) la fotosíntesis en plantas C 3 es siempre inferior a la de las plantas C 4 y es subóptima. Si la concentración de CO 2 cae demasiado, la pérdida de carbono de la respiración excede la ganancia de carbono de la fotosíntesis. El punto en el que la respiración y la fotosíntesis, es decir , la formación y fijación de CO 2 , están en equilibrio, es el punto de compensación de CO 2 Γ. En el caso de las plantas C 3 , este punto es 0,00 C3 = 0,005 a 0,010% por volumen de concentración de CO 2 ; la tasa de fotosíntesis está saturada de 0,05 a 0,10% por volumen. Para plantas C 4 , Γ C4 es 0.001% por volumen. Gracias a su bomba de CO 2 , estas plantas pueden realizar la fotosíntesis incluso con una concentración de CO 2 muy baja .
La concentración local de CO 2 en las capas de aire cercanas al suelo puede aumentarse fertilizando con compost . Aquí, los microorganismos utilizan el material orgánico de forma oxidativa para que, entre otras cosas, Se libera CO 2 . En los invernaderos , la concentración de CO 2 aumenta con la fumigación y conduce a un mayor rendimiento de biomasa a través de una mayor fotosíntesis. Sin embargo, la intensidad de la luz no debe convertirse en un factor limitante (consulte la siguiente sección).
Una concentración demasiado alta de CO 2 (más del 1% en volumen) puede dañar muchas plantas.
luz
La fotosíntesis es un proceso impulsado por la luz y la tasa de fotosíntesis depende principalmente de la intensidad de la luz . Hasta una intensidad de luz específica de la especie, la tasa de fotosíntesis aumenta con la intensidad de la luz. Las hojas de una planta a menudo siguen la posición del sol y están orientadas lo más perpendiculares posible a la luz para aumentar la iluminancia . La posición de los cloroplastos también está alineada para lograr la mayor tasa de fotosíntesis posible. En condiciones de luz tenue, por ejemplo con una gran nubosidad, el lado ancho de los cloroplastos está expuesto a la luz, mientras que este es el lado estrecho bajo una luz intensa. Esta orientación está mediada por el citoesqueleto .
En el caso de las plantas C 3 , la saturación se produce al aumentar la iluminancia; un aumento adicional de la iluminancia no aumenta la tasa de fotosíntesis. Este punto es el punto de saturación de luz . La razón de esto es la concentración limitante de CO 2 en el aire. Con un 0,03% en volumen, esto es subóptimo para las plantas C 3 (consulte la sección anterior). Sin embargo, en comparación con las plantas C 3 , las plantas C 4 no dependen de la concentración atmosférica de CO 2 . Por lo tanto, cuando aumenta la intensidad de la luz, incluso a plena luz del sol , la tasa de fotosíntesis no experimenta saturación y siempre está limitada por la luz. Además, la saturación de la luz se produce en diferentes plantas a diferentes niveles de iluminancia: " plantas de luz " y " plantas de sombra ".

Las llamadas " plantas de sombra " se adaptan a intensidades de luz más bajas y las llamadas " plantas solares " o " plantas de luz" a intensidades de luz más altas . También puede producirse una diferenciación análoga de la forma de la hoja dentro de una misma planta. En el caso de la haya, por ejemplo, hay hojas de sol pequeñas y gruesas, mientras que las hojas de sombra grandes y delgadas están cerca del suelo con intensidades de luz más bajas. El parénquima en empalizada es más complejo en las hojas del sol, por lo que se puede aprovechar mejor la fuerte radiación solar.
Las plantas solares (y las hojas solares) como el berro solo tienen una alta tasa de fotosíntesis a altas intensidades de luz, la saturación de luz aquí es mucho mayor que con las plantas de sombra (u hojas de sombra). Las plantas de sombra, como la acedera de madera , pueden realizar la fotosíntesis incluso a intensidades de luz más bajas. Sin embargo, la tasa de fotosíntesis es menor con ellas que con plantas solares, ya que la saturación de luz se alcanza a niveles bajos de iluminancia (ver también figura).
A niveles bajos de iluminancia, la fotosíntesis tiene lugar con muy poca eficiencia, por lo que la ganancia de carbono en forma de asimilados (y la producción de oxígeno) es menor que la pérdida de carbono (asimilado) (y el consumo de oxígeno) en la respiración celular . El punto en el que se equilibran la fotosíntesis y la respiración celular es el punto de compensación de la luz . Esto varía en altura en diferentes plantas, más alto en plantas C 4 y más bajo en plantas solares. Las plantas de sombra tienen el punto de compensación de luz más bajo y, como resultado, aún pueden realizar la fotosíntesis neta incluso con intensidades de luz muy bajas.
Una iluminancia excesiva puede provocar daños ( fotodestrucción ) y, por tanto, una reducción de la tasa de fotosíntesis. Este es el caso, por ejemplo, de las plantas de sombra que se exponen repentinamente al sol abrasador. La luz solar también puede causar daños a bajas temperaturas debido a la reducción de la actividad enzimática.
Después de que se reconoció que la tasa de fotosíntesis con una mezcla de diferentes colores de luz es mayor que con la irradiación con luz monocromática ( efecto Emerson ), es decir, existe una influencia mutua, se propuso en 2009 que se debería utilizar el rendimiento cuántico de luz monocromática adicional. para determinar la radiación fotosintéticamente activa para medir diferentes longitudes de onda bajo iluminación de fondo blanco . Esto llevó a la comprensión de que el rendimiento cuántico fotosintético de la luz verde es aproximadamente el mismo que el de la luz roja y mayor que el de la luz azul. Ya en 2004, las pruebas prácticas llevaron a un crecimiento de las plantas más rápido y un mayor rendimiento de biomasa después de la adición de luz verde (500 a 600 nm). Además, la alineación de las hojas (en la dirección de la fuente de luz) con la ayuda de la luz verde puede conducir a una mayor tasa de fotosíntesis debido a la fotomorfogénesis , lo que resulta en más biomasa.
Suministro de agua y humedad
Aunque el agua está incluida en la ecuación de la fotosíntesis, siempre está disponible en cantidades suficientes para la reacción bioquímica. Se estima que 1875 km³ de agua se convierten en fotosíntesis cada año. Sin embargo, el CO se lleva a cabo 2 influjos en las hojas a través de los estomas , que -dependiendo de la humedad presente abierta o cerrada- o el suministro de agua de la hoja. Como resultado, la humedad del aire y el suministro de agua a las plantas superiores a través de las raíces ( estrés hídrico , estrés por sequía ) tienen un efecto sobre la fotosíntesis: cuando está seco, los estomas son cerrados por las células de protección para proteger a la planta del secado. fuera. Como resultado, casi nada de CO 2 ingresa a la hoja, por lo que se convierte en un factor limitante. Debido a su enriquecimiento en CO 2 , las plantas C 4 no se ven tan afectadas como las plantas C 3 (ver arriba). Una adaptación especial a la falta de agua es el metabolismo del ácido crasuláceo en las llamadas plantas CAM.
El riego artificial puede aumentar la humedad y, por tanto, la tasa de fotosíntesis.
temperatura
| Tipo de planta | Temperatura mínima | Temperatura óptima | Temperatura máxima |
| Planta C 4 | 5 hasta 7 ° C | 35 hasta 45 ° C | 50 hasta 60 ° C |
| Planta C 3 | −2 a 0 ° C | 20 hasta 30 ° C | 40 hasta 50 ° C |
| Planta solar | −2 a 0 ° C | 20 hasta 30 ° C | 40 hasta 50 ° C |
| Planta de sombra | −2 a 0 ° C | 10 hasta 20 ° C | 40 hasta 50 ° C |
| Árboles de hoja caduca tropicales de hoja perenne | 0 hasta 5 ° C | 25 hasta 30 ° C | De 45 a 50 ° C |
| Árboles de hoja caduca de latitudes moderadas | −3 a −1 ° C | 15 hasta 25 ° C | 40 hasta 45 ° C |
| Coníferas | −5 a −3 ° C | 10 hasta 25 ° C | 35 hasta 40 ° C |
| tejido | −15 a −10 ° C | 5 hasta 15 ° C | 20 hasta 30 ° C |
La fotosíntesis es en parte una cuestión de reacciones bioquímicas. Como toda reacción (bio) química, también depende de la temperatura, a diferencia de los procesos fotoquímicos. La temperatura óptima para las enzimas (principalmente para la parte de la fotosíntesis independiente de la luz) también determina la temperatura óptima para una tasa máxima de fotosíntesis. Esto se debe a que el aceptor de electrones de la parte de la fotosíntesis que depende de la luz (NADP + ) se regenera (oxida) en el ciclo de Calvin y, si hay una deficiencia de NADP + , también se restringe la fotosíntesis. La fotosíntesis solo puede tener lugar por encima de una temperatura mínima, por ejemplo, es -1 ° C en plantas resistentes a las heladas. (ver también la tabla a continuación). La tasa de fotosíntesis aumenta al aumentar la temperatura. Según la regla RGT de van 't Hoff , la velocidad de reacción generalmente se duplica para cuadriplicarse cuando la temperatura aumenta en 10 ° C. La fotosíntesis finalmente alcanza una temperatura óptima. Para las plantas de nuestras latitudes, los óptimos están entre 20 y 30 ° C. En el caso de las cianobacterias termófilas, sin embargo, la temperatura óptima es de 70 ° C.
Una vez alcanzado este óptimo, la producción fotosintética vuelve a caer debido al inicio de la desnaturalización de las proteínas de las enzimas responsables de la fotosíntesis y finalmente se detiene por completo.
Contenido de clorofila
Debido al alto contenido de clorofila en las células, nunca se convierte en un factor limitante en la fotosíntesis. Solo se pueden observar ciertas variaciones de plantas de sol y sombra. Estas últimas tienen un mayor contenido de clorofila que las plantas solares y particularmente la grana grande . Las antenas más grandes de las plantas de sombra también tienen una proporción de clorofila a / b más alta que las plantas solares. Esto cierra un poco mejor la brecha verde .
importancia
En las condiciones actuales de irradiación de energía solar, las plantas unen alrededor de 440 mil millones de toneladas de dióxido de carbono cada año, de las cuales alrededor de 220 mil millones de toneladas se liberan a la atmósfera a través de la respiración de las plantas , el resto se une como biomasa o se transporta al suelo . La fotosíntesis impulsa directa o indirectamente todos los ciclos biogeoquímicos en todos los ecosistemas existentes en la tierra. Incluso las comunidades litotróficas de los manantiales hidrotermales , que utilizan compuestos inorgánicos de origen geotérmico como fuente de energía y están completamente aisladas de la luz del sol, dependen del oxígeno, el subproducto de la fotosíntesis.
En la actualidad, las plantas terrestres son responsables de alrededor del 50% de la producción fotosintética primaria . El 30% están representados por algas y protistas autótrofos , por ejemplo entre los dinoflagelados , el 20% por procariotas como las cianobacterias .
La fijación global de CO 2 tiene lugar casi exclusivamente a través del proceso de fotosíntesis oxigenada, a través de plantas y bacterias fotosintéticas. Las bacterias aeróbicas fotosintéticas en el mar representan del 2 al 5% de la fotosíntesis marina. La importancia de la fotosíntesis anoxigénica para la fijación global de CO 2 es inferior al 1%. Hay dos razones para esto. Por un lado, las bacterias fototróficas de azufre, que representan el grupo dominante entre los organismos fototróficos anoxigénicos en los ecosistemas, solo se presentan en altas densidades en algunas zonas límbicas y marinas de mareas. Los ecosistemas en cuestión para estos organismos también solo contribuyen alrededor del 4% a la producción primaria global. En los lagos con bacterias de azufre fototróficas, la proporción de producción primaria a través de la fotosíntesis anoxigénica es de alrededor del 29%. Por lo tanto, con base en la investigación actual, se asume que la fotosíntesis anoxigénica contribuye menos del 1% a la producción primaria global. El segundo factor limitante para la contribución de la fotosíntesis anoxigénica a la producción primaria global es la dependencia de estos organismos de compuestos reducidos de azufre . Estos compuestos se forman durante la degradación anaeróbica de compuestos orgánicos a CO 2 con sulfato ; la llamada reducción de sulfato bacteriano . Dado que este carbono orgánico ha sido previamente fijado por fotosíntesis oxigenada, la fotosíntesis basada en compuestos de azufre bacteriogénicos no da como resultado un aumento neto de compuestos orgánicos para los niveles tróficos más altos en la cadena alimentaria. Por esta razón, Norbert Pfennig introdujo el término "producción primaria secundaria" en 1978. Por lo tanto, los organismos fototróficos anoxigénicos solo pueden compensar las pérdidas de compuestos orgánicos que surgen durante la mineralización. Los manantiales de azufre geotérmicos son una excepción a esto, ya que los compuestos de azufre reducido provienen de fuentes abióticas.
Además de la fijación de CO 2 , la formación de oxígeno también juega un papel importante en la fotosíntesis oxigenada . En la Tierra, el oxígeno molecular elemental (dioxígeno, O 2 ) está presente en forma gaseosa en la atmósfera terrestre y se disuelve en agua. Aproximadamente el 99% del oxígeno proviene de la fotosíntesis. Sin la fotosíntesis oxigénica, los organismos aeróbicos como los humanos y los animales no podrían vivir porque lo necesitan para respirar.
- Todas las materias primas fósiles y las reservas de energía, como el lignito , la hulla y el petróleo , también son subproductos de la fotosíntesis.
- En la estratosfera , el ozono (O 3 ) se forma a partir del dioxígeno (O 2 ) , que absorbe gran parte de la radiación ultravioleta dañina para los seres vivos . Sólo entonces es posible la vida en la tierra.
- La vegetación crea un clima más equilibrado mediante la sombra y la evaporación .
evolución
Debido a la importancia de la fotosíntesis para la vida en la tierra, la ciencia se preocupó muy temprano por el origen y desarrollo de la fotosíntesis. Para aclarar esta cuestión se recogieron datos de distintas disciplinas como la geología , la biogeoquímica , la bioquímica comparada y la evolución molecular . Sin embargo, responder a esta pregunta sigue siendo un desafío científico y aún no se ha aclarado de manera concluyente. En algunos casos incluso se cree que las huellas necesarias para responder a la pregunta ya no existen, ya que la fotosíntesis se originó muy temprano en el desarrollo de la vida y la tierra y sus huellas se perdieron con el tiempo.
Lo que es seguro, sin embargo, es que la fotosíntesis anoxigénica ocurrió antes de la oxigenación. La fotosíntesis anoxigénica podría haberse establecido hace unos 3.500 millones de años ( Ga ). Según otra estimación, la fotosíntesis con hidrógeno (H 2 ) como agente reductor se realizó antes de 3.8 Ga . Antes de 3.4 Ga, la fotosíntesis se realizaba con H 2 S, antes de 3.0 Ga también con Fe 2+ como agente reductor (por protocianobacterias y proteobacterias).
De gran interés es la determinación de la época en que las protocianobacterias llevaron a cabo la fotosíntesis oxigenada . Esto todavía se discute de manera controvertida en la ciencia, pero la mayoría de la opinión está surgiendo de que la fotosíntesis oxigénica ya debe haber estado bien establecida cuando la atmósfera casi anóxica se enriqueció con oxígeno ( Gran Evento de Oxidación ) . Este punto en el tiempo de enriquecimiento de oxígeno atmosférico es presumiblemente entre 2,3 y 2,4 Ga antes del presente. Sin embargo, a partir de este evento, no se puede inferir cuándo comenzó la fotosíntesis oxigénica. Porque el primer oxígeno generado bioquímicamente con toda probabilidad no llegó a la atmósfera, sino que se utilizó para la oxidación de sustancias disueltas (incluido el Fe 2+ ).
Para reducir el tiempo, se dan varias pistas (marcadores) desde tres direcciones principales: estromatolitos , microfósiles y moléculas conocidas como biomarcadores .
Los estromatolitos son calizas laminadas formadas por capas alternas de biopelícula (biomates) y depósitos de sedimentos . Los estromatolitos se pueden probar mediante hallazgos de fósiles de - 2.8 Ga. Sin embargo, también hay indicaciones para estromatolitos de hasta 3,1-3,5 Ga de edad. En algunos de estos estromatolitos fósiles se pueden observar estructuras que fueron interpretadas como restos de bacterias filiformes que se asemejan a las cianobacterias fototróficas que se pueden detectar en los estromatolitos recientes . Pero ni el origen biogénico de estos microfósiles ni su actividad como fotótrofos oxigenados ni el origen biogénico de la mayoría de los estromatolitos son seguros.
Además de los hallazgos filogenéticos no del todo fiables sobre microorganismos fototróficos (véase más adelante), también se analizan moléculas marcadoras. Se trata de hidrocarburos especiales, la presencia de metales sensibles a la reducción-oxidación ( Mo , Re ) y la composición de sistemas isotópicos específicos. Marcador de hidrocarburo único para las cianobacterias Hopane , pero también se investigaron los esteranos . La composición isotópica de uranio - torio - plomo puede utilizarse para evaluar si existían condiciones anóxicas u óxicas: en condiciones óxicas, solo el uranio forma óxidos solubles y, por lo tanto, es "más móvil".
El siguiente programa se puede estimar a partir de los datos recopilados:
- antes de 3.8 Ga: posiblemente primeros rastros de enriquecimiento local de oxígeno en el suelo (mediciones de U-Th-Pb); Sin embargo, estos no necesariamente tienen que indicar la presencia de la primera fotosíntesis oxigenada.
- 3.2 Ga ago : primeros signos de fotosíntesis oxigenada en la Australia actual: pizarra negra espesa , apirítica y rica en kerógenos
- 2.72 Ga ago: Los estromatolitos en las capas de sedimentos del lago indican una fotosíntesis oxigenada establecida
- antes de 2,5 Ga: Mo, los marcadores Re indican un aumento de O 2
- antes de 2.45 Ga: numerosos esteranos y hopanos muestran que la fotosíntesis oxigénica está establecida
- antes de 2.3 Ga: la fotosíntesis oxigénica establecida fuera de toda duda, la concentración de O 2 en la atmósfera ha aumentado drásticamente
Sin embargo, también se critica el programa antes mencionado y se clasifica el momento para el desarrollo de la fotosíntesis oxigénica en el momento de la Edad de Hielo de Makganyene (antes de aproximadamente 2,2 Ga). Esto se debe a que, por ejemplo, el peróxido de hidrógeno (H 2 O 2 ) se acumula en el hielo y luego puede liberarse en grandes cantidades. El H 2 O 2 y también el O 2 se generan a partir del agua mediante procesos fotoquímicos abióticos que utilizan luz ultravioleta . También es posible que los hopanos también estén formados por fotótrofos anoxigénicos.
Otro método utilizado anteriormente fue el análisis de la composición isotópica del carbono. Esto permite sacar conclusiones sobre si el CO 2 se ha fijado bióticamente. La enzima clave de la fotosíntesis oxigenada, RubisCO, es decisiva para ello. Durante la asimilación de C del CO 2 durante la fotosíntesis, se discrimina el isótopo de carbono 13 C más pesado pero estable , mientras que el isótopo de carbono 12 C más ligero es incorporado cada vez más por el RuBisCO. Como resultado, el carbono unido en sustancias orgánicas es más pobre a 13 C en comparación con el carbono en sustancias inorgánicas . Las mediciones de compuestos de carbono orgánico e inorgánico de sedimentos de 3,5 a 3,8 Ga mostraron un δ 13 C de −27 a +7 ‰ para porción y +0,4 a +2,6 ‰ para la porción inorgánica. Puesto que estos valores corresponden muy bien con las mediciones actuales, esto ha sido considerado como una indicación de un biogénico CO inicial 2 de fijación. No se puede deducir de los datos si se trató de una fijación de CO 2 impulsada por la fotosíntesis , ya que los fijadores quimiolitotróficos de CO 2 también tienen valores similares de δ 13 C. Esto hace que este método no sea adecuado para fechar la fotosíntesis.
Sistemas fotosintéticos
Una comparación del genoma de cinco tipos de bacterias, cada una de las cuales representa uno de los cinco tipos básicos de fotosíntesis bacteriana, mostró que los componentes del aparato fotosintético se desarrollaron inicialmente de forma independiente entre sí en diferentes bacterias y se unieron mediante transferencia horizontal de genes . Una comparación de los genes que estas bacterias tienen en común con los genomas de otras bacterias incapaces de realizar la fotosíntesis mostró que la mayoría de los genes de la fotosíntesis también se encuentran en estas bacterias. Está en debate si las Chloroflexaceae ( bacterias verdes sin azufre ) fueron los primeros organismos en ser fotoautótrofos mediante la transferencia horizontal de genes. Un buen candidato para una fotoautotrofia inicial son las protocianobacterias ahora extintas (sinónimo de procianobacterias o proprotocianobacterias), hipotéticas precursoras anoxigénicas de las cianobacterias actuales. Estos podrían haber transmitido genes a Heliobacteria, Chloroflexaceae, bacterias violetas y Chlorobiaceae mediante transferencia horizontal de genes.
Los datos de secuencia por sí solos no se pueden utilizar para determinar qué tipo de bacteria fue la primera en realizar la fotosíntesis. Para este propósito, se deben utilizar datos de otras fuentes (independientes) (consulte la sección anterior).
tecnología
- Un intento de hacer que la luz sea utilizable en sistemas técnicos es, por ejemplo, la celda de Grätzel . El objetivo es producir células solares orgánicas con un alto grado de eficiencia para generar electricidad. Como ocurre con la fotosíntesis, la energía luminosa se hace utilizable por medio de sustancias orgánicas, pero a diferencia de la fotosíntesis, no se sintetizan sustancias.
- Las algas se cultivan en biorreactores ( reactores de algas ). Esto permite secuestrar el CO 2 industrialmente y producir alimentos y combustible.
Ver también
- Quimiotrofia ( quimiosíntesis )
- Fotosíntesis artificial
literatura
- Katharina Munk (Ed.): Libro de texto de bolsillo Biología: Microbiología . Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3 .
- Hans W. Heldt , Birgit Piechulla: Bioquímica vegetal. 4ª edición. Spectrum Academic Publishing House, Heidelberg 2008, ISBN 978-3-8274-1961-3 .
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Bioquímica vegetal . Garland Pub, Nueva York, NY 2008, ISBN 978-0-8153-4121-5 .
- David L. Nelson, Michael M. Cox: Principios de bioquímica de Lehninger. 5ª edición. Freeman, Nueva York, NY 2008, ISBN 978-0-7167-7108-1 .
- Georg Fuchs (Ed.): Thomas Eitinger, Erwin Schneider; Fundada por Hans. G. Schlegel: Microbiología general. 8ª edición. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1 .
- Neil A. Campbell: Biología . Libro de texto Spectrum, sexta edición. Editado por J. Markl. Spektrum Verlag, Heidelberg, Berlín 2003, ISBN 3-8274-1352-4 .
- Donat-Peter Häder (Ed.): Fotosíntesis . Georg Thieme Verlag, Stuttgart, Nueva York 1999, ISBN 3-13-115021-1 .
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger - libro de texto de botánica. 36ª edición. Spectrum Academic Publishing House, Heidelberg 2008, ISBN 978-3-8274-1455-7 .
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botánica . 5. completamente revisado Edición. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31179-8 .
- Peter H. Raven, Ray F. Evert, Susan E. Eichhorn: Biología de las plantas. 4ª edición. Gruyter, Berlín, Nueva York 2006, ISBN 978-3-11-018531-7 .
- Elmar Weiler, Lutz Nover, Wilhelm Nultsch: botánica general y molecular . Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-147661-6 .
- MF Hohmann-Marriott, RE Blankenship: Evolución de la fotosíntesis. En: Annu Rev Plant Biol . Vol. 62, 2011, págs. 515-548. PMID 21438681 ; doi: 10.1146 / annurev-arplant-042110-103811
enlaces web
- Botánica online: fotosíntesis
- Revista científica Photosynthetica en inglés
- Revista científica de investigación de la fotosíntesis en inglés
- Introducción original en forma de libros (inglés)
- Fotosíntesis: resuelto el misterio del ciclo de los electrones
Evidencia individual
- ↑ Annette Junker: La vitamina D protege. En: Deutscher Apotheker-Zeitung 2008, No. 31, p. 31.
- ↑ a b c d M. T. Madigan, JM Martinko: Microbiología de Brock . Múnich, 2006: 613-614, ISBN 3-8273-7187-2 .
- ^ BM Griffin, J. Schott, B. Schink: Nitrito, un donante de electrones para la fotosíntesis anoxigénica. En: Science 316, 2007, p. 1870 doi: 10.1126 / science.1139478
- ↑ a b M. T. Madigan, JM Martinko: Microbiología de Brock . Múnich, 2006: 621, ISBN 3-8273-7187-2 .
- ↑ MT Madigan, JM Martinko: Microbiología de Brock . Múnich, 2006: 456, ISBN 3-8273-7187-2 .
- ↑ MT Madigan, JM Martinko: Microbiología de Brock . Múnich, 2006: 444-447, ISBN 3-8273-7187-2 .
- ↑ MT Madigan, JM Martinko: Microbiología de Brock . Múnich, 2006: 448-449, ISBN 3-8273-7187-2 .
- ^ David L. Nelson, Michael M. Cox: Principios de bioquímica de Lehninger. 5ª edición. Freeman, Nueva York, NY 2008, ISBN 978-0-7167-7108-1 , p. 761.
- ↑ DA Bryant. et al . Candidatus Chloracidobacterium thermophilum: Acidobacteria fototrófica aeróbica. En: Science , 317 ; 523-526 (2007).
- ^ Karl Mägdefrau: Historia de la botánica . Gustav Fischer, Stuttgart 1973. pág.80.
- ^ Karl Mägdefrau: Historia de la botánica . Gustav Fischer, Stuttgart 1973. págs. 84-86.
- ↑ Ilse Jahn (Ed.): Historia de la biología . 3a edición, edición especial Nikol, Hamburgo 2004, p. 319f.
- ↑ Ilse Jahn (Ed.): Historia de la biología . 3ª edición, edición especial Nikol, Hamburgo 2004, págs. 515-518.
- ↑ Elmar Weiler, Lutz Nover, Wilhelm Nultsch: Botánica general y molecular . Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-147661-6 , pág.261 .
- ^ Georg Fuchs (eds.): Thomas Eitinger, Erwin Schneider; Fundada por Hans. G. Schlegel: Microbiología general. 8ª edición. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1 , pág.425 .
- ↑ a b Barber, J. (2009): Conversión de energía fotosintética: natural y artificial. En: Chem Soc Rev . 38 (1); 185-196; PMID 19088973 ; doi: 10.1039 / b802262n
- ↑ Hans W. Heldt, Birgit Piechulla: Bioquímica vegetal. 4ª edición. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , pág.88.
- ↑ A. Guskov y col. (2009): Fotosistema II de cianobacterias con resolución 2.9-A y el papel de quinonas, lípidos, canales y cloruros. En: Nat Struct Mol Biol . 16 (3); 334-342; PMID 19219048 ; doi: 10.1038 / nsmb.1559
- ↑ Rappaport et al (2002): Cinética y vías de recombinación de carga en el fotosistema II En: Biochemistry 41 (26), pp. 8518-8527; PMID 12081503
- ↑ Dau y col . (2004): La estructura del complejo de manganeso del Fotosistema II en su estado S 1 estable a la oscuridad - Resultados EXAFS en relación con datos cristalográficos recientes. En: Phys Chem Chem Phys 6 (20) págs. 4781-4792
- ↑ Ferreira et al . (2004): Arquitectura del centro fotosintético generador de oxígeno. En: Science 303 (5665), págs. 1831-1838; PMID 14764885
- ↑ JS Rieske, DH Maclennan, Coleman, R. (1964): Aislamiento y propiedades de una proteína de hierro del complejo (coenzima Q reducida) -citocromo C reductasa de la cadena respiratoria. En: Comunicaciones de investigación bioquímica y biofísica 15 (4); 338-344; doi: 10.1016 / 0006-291X (64) 90171-8
- ^ Mitchell (1975): mecanismo redox del motivo protónico del complejo citocromo-b-c1 en la cadena respiratoria - ciclo de ubiquinona del motivo protónico. En: FEBS Lett 56 (1) págs. 1-6
- ↑ a b c Baniulis et al (2008): Estructura-función del complejo citocromo b6f. En: Photochem Photobiol 84 (6) págs. 1349-1358, PMID 19067956
- ^ Haehnel (1984): Transporte de electrones fotosintéticos en plantas superiores. En: Annu Rev Plant Biol 35 págs. 659-693.
- ↑ Hope (2000): Transferencias de electrones entre el citocromo f, la plastocianina y el fotosistema I: cinética y mecanismos. En: Biochim Biophys Acta 1456 (1) págs. 5-26; PMID 10611452
- ^ David L. Nelson, Michael M. Cox: Principios de bioquímica de Lehninger. 5ª edición. Freeman, Nueva York, NY 2008, ISBN 978-0-7167-7108-1 , p. 753.
- ↑ Sacksteder et al (2000): La estequiometría de protón a electrón de la fotosíntesis en estado estacionario en plantas vivas: un ciclo Q de bombeo de protones se activa continuamente. En: Proc Natl Acad Sci USA 97 (26) págs. 14283-14288; PMID 11121034
- ↑ Mitchell (1961): Acoplamiento de la fosforilación a la transferencia de electrones e hidrógeno mediante un mecanismo de tipo quimiosmótico. En: Nature 191 (4784) págs. 144-148
- ↑ Seelert et al : Biología estructural. Turbina de protones de un motor de planta. En: Nature 405 (6785) págs. 418-419; PMID 10839529
- ↑ Junge y Nelson (2005): Biología estructural. Electromotores rotativos de la naturaleza. En: Science 308 (5722) págs. 642-644; PMID 15860615
- ↑ A. Robertazzi, A. Galstyan, Knapp, EW. (2014): Reimpresión del grupo de manganeso PSII: protonación de W2, O5, O4 e His337 en el estado S1 explorado mediante cálculos combinados de energía química cuántica y electrostática. En: Biochim Biophys Acta . 1837 (9); 1389-1394; doi: 10.1016 / j.bbabio.2014.07.008 ; PMID 25065862
- ↑ a b c M. Suga y col. (2014): Estructura nativa del fotosistema II con una resolución de 1,95 Å vista por pulsos de rayos X de femtosegundos. En: Nature PMID 25470056 ; doi: 10.1038 / nature13991
- ↑ a b c K. Sauer, J. Yano, Yachandra, VK. (2008): espectroscopia de rayos X del complejo fotosintético que genera oxígeno. En: Coord Chem Rev . 252 (3-4); 318-335; PMID 19190720 ; PMC 2387253 (texto completo gratuito)
- ↑ EM Sproviero et al. (2008): Estudio de mecánica cuántica / mecánica molecular del ciclo catalítico de la división del agua en el fotosistema II. En: J Am Chem Soc . 130 (11); 3428-3442; PMID 18290643 ; doi: 10.1021 / ja076130q .
- ↑ H. Dobbek y col. (2001): La estructura cristalina de una deshidrogenasa de monóxido de carbono revela un grupo [Ni-4Fe-5S]. En: Science 293 (5533); 1281-1285; PMID 11509720 ; doi: 10.1126 / science.1061500 .
- ↑ Y. Pushkar y col. (2008): Cambios estructurales en el cúmulo de Mn 4 Ca y el mecanismo de división del agua fotosintética. En: Proc Natl Acad Sci USA 105 (6); 1879-1884; PMID 18250316 ; PMC 2542863 (texto completo gratuito)
- ↑ Debus, RJ (2015): estudios FTIR de ligandos metálicos, redes de enlaces de hidrógeno y moléculas de agua cerca del clúster del sitio activo Mn4CaO5 en el fotosistema II.En : Biochim Biophys Acta 1847 (1); 19-34; PMID 25038513 ; doi: 10.1016 / j.bbabio.2014.07.007
- ↑ Barber, J. (2008): Generación fotosintética de oxígeno. En: Philos Trans R Soc Lond B Biol Sci . 363 (1504); 2665-2674; PMID 18468983 .
- ↑ a b Conlan, B. (2008): Diseño del fotosistema II: ingeniería molecular de proteínas fotocatalíticas. En: Photosynth Res . 98 (1-3); 687-700; PMID 18777102 ; doi: 10.1007 / s11120-008-9355-5 .
- ↑ ¡La cámara está funcionando! Los investigadores filman el fotosistema II en acción Redacción Pflanzenforschung.de; fechado el 23 de julio de 2014, consultado el 28 de octubre de 2014.
- ↑ B. Kok, B. Forbush, McGloin, M. (1970): Cooperación de cargas en la evolución fotosintética de O 2 -I. Un mecanismo lineal de cuatro pasos. En: Photochem Photobiol . 11 (6); 457-475; PMID 5456273 ; doi: 10.1111 / j.1751-1097.1970.tb06017.x .
- ↑ Toshiharu Shikanai: red de regulación de la fuerza motriz de protones: contribución del transporte cíclico de electrones alrededor de Fotosistema I . En: Investigación de la fotosíntesis . cinta 129 , no. 3 , 1 de septiembre de 2016, pág. 253–260 , doi : 10.1007 / s11120-016-0227-0 ( springer.com [consultado el 31 de marzo de 2017]).
- ↑ Hans W. Heldt, Birgit Piechulla: Bioquímica vegetal. 4ª edición. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , págs. 103 y siguientes.
- ↑ Mehler, AH. (1951): Estudios sobre reacciones de cloroplastos iluminados: I. Mecanismo de reducción de oxígeno y otros reactivos de colina. En: Arch Biochem Biophys 33 (1); 65-77; PMID 14857775 ; doi: 10.1016 / 0003-9861 (51) 90082-3
- ↑ AH Mehler, Brown, AH. (1952): Estudios sobre reacciones de cloroplastos iluminados. III. Estudio de fotoproducción y consumo simultáneo de oxígeno con isótopos de oxígeno. En: Arch Biochem Biophys 38 (1); 365-370; PMID 12997112 ; doi: 10.1016 / 0003-9861 (52) 90042-8
- ↑ a b Asada, K. (2000): El ciclo agua-agua como sumideros alternativos de fotones y electrones. En: Philos Trans R Soc Lond B Biol Sci . 355 (1402); 1419-1431; PMID 11127996 ; PMC 1692883 (texto completo gratuito, PDF).
- ↑ C. Hackenberg. et al . (2009): El metabolismo fotorrespiratorio del 2-fosfoglicolato y la fotorreducción de O2 cooperan en la aclimatación a la luz alta de Synechocystis sp. cepa PCC 6803. En: Planta 230 (4); 625-637; PMID 19578872 ; PMC 2729987 (texto completo gratuito, PDF).
- ^ Albertsson (2001): un modelo cuantitativo de la estructura del dominio de la membrana fotosintética. En: Trends Plant Sci 6 (8) págs. 349-58.
- ↑ A. Shapiguzov y col. (2010): La fosfatasa PPH1 está específicamente involucrada en la desfosforilación de LHCII y las transiciones de estado en Arabidopsis. En: PNAS 9; 107 (10); 4782-4787; PMID 20176943 ; PDF (acceso gratuito a texto completo)
- ^ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Bioquímica vegetal . Garland Pub, Nueva York, NY 2008, ISBN 978-0-8153-4121-5 , p. 89.
- ↑ Hans W. Heldt, Birgit Piechulla: Bioquímica vegetal. 4ª edición. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , pág.110.
- ^ R. Scheuermann, K. Biehler, T. Stuhlfauth y HP Fock (1991): Las mediciones simultáneas de intercambio de gases y fluorescencia indican diferencias en la respuesta de girasol, frijol y maíz al estrés hídrico . En: Photosynthesis Research 27 (3): 189-197, doi : 10.1007 / BF00035840 (actualmente no disponible) .
- ^ BM Griffin, J. Schott, B. Schink: Nitrito, un donante de electrones para la fotosíntesis anoxigénica. En: Science 316 (5833), 2007, p. 1870; PMID 17600210 ; doi: 10.1126 / science.1139478 .
- ^ Georg Fuchs (eds.): Thomas Eitinger, Erwin Schneider; Fundada por Hans. G. Schlegel: Microbiología general. 8ª edición. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1 , pág.432 .
- ↑ Blankenship, RE, Madigan, MT y Bauer, CE (2006). Bacterias fotosintéticas anoxigenicas (Springer Science & Business Media).
- ↑ Katharina Munk (ed.): Libro de texto de bolsillo Biología: Microbiología . Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3 , pág.341 .
- ^ David L. Nelson, Michael M. Cox: Principios de bioquímica de Lehninger. 5ª edición. Freeman, Nueva York, NY 2008, ISBN 978-0-7167-7108-1 , p. 751.
- ↑ Katharina Munk (ed.): Libro de texto de bolsillo Biología: Microbiología . Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3 , pág.343 .
- ↑ a b Georg Fuchs (ed.): Thomas Eitinger, Erwin Schneider; Fundada por Hans. G. Schlegel: Microbiología general. 8ª edición. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1 , pág.434 .
- ↑ M. Heinnickel, Golbeck, JH. (2007): Fotosíntesis de heliobacterias. En: Photosynth Res . 92 (1); 35-53; PMID 17457690 ; doi: 10.1007 / s11120-007-9162-4 .
- ↑ JT Beatty et al .: Un anaerobio bacteriano fotosintético obligado de un respiradero hidrotermal de aguas profundas. En: Proc Natl Acad Sci USA Vol. 102, No. 26, 2005, págs. 9306-9310. PMID 15967984 ; PDF (acceso a texto completo)
- ↑ Fotosíntesis en las profundidades marinas. (Ya no está disponible en línea). Archivado desde el original el 29 de enero de 2012 ; Consultado el 8 de enero de 2011 .
- ^ Georg Fuchs (eds.): Thomas Eitinger, Erwin Schneider; Fundada por Hans. G. Schlegel: Microbiología general. 8ª edición. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1 , pág.411
- ↑ Linktext , Tang et al., 2010
- ↑ Blankenship, RE, Madigan, MT y Bauer, CE (2006). Bacterias fotosintéticas anoxigenicas (Springer Science & Business Media)
- ^ Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger - Libro de texto de botánica. 36ª edición. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7 , pág.317.
- ↑ Elmar Weiler, Lutz Nover, Wilhelm Nultsch: Botánica general y molecular . Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-147661-6 , pág.279 .
- ↑ Katharina Munk (ed.): Estudios básicos en biología. Botánica . Spektrum Akademischer Verlag, Heidelberg 2001, ISBN 3-8274-0909-8 , págs. 6-6.
- ↑ Munk, Katharina (ed.): Estudios básicos en biología. Botánica . Spektrum Akademischer Verlag, Heidelberg 2001, ISBN 3-8274-0909-8 , págs. 5-27.
- ^ A b Hermann Linder: Biología . Schroedel; 21., reelaboración. Edición 1998, ISBN 3-507-10580-2 , p. 43.
- ^ A b Wilhelm Nultsch: Botánica general . Georg Thieme Verlag; 10a, edición revisada 1996, ISBN 3-13-383310-3 , págs. 309-311.
- ↑ T. Stuhlfauth, HP Fock (1990): Efecto del enriquecimiento de CO 2 de toda la temporada en el cultivo de una planta medicinal, Digitalis lanata. En: J Agronomy & Crop Science 164 (3), 168-173; doi: 10.1111 / j.1439-037X.1990.tb00803.x
- ↑ a b c Ulrich Lüttge , Manfred Kluge, Gabriela Bauer: Botánica . 5. completamente revisado Edición. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31179-8 , págs. 472 y sig.
- ↑ a b c Hermann Linder: Biología . Schroedel; 21., reelaboración. Edición 1998, ISBN 3-507-10580-2 , págs. 48-49.
- ↑ T. Stuhlfauth y HP Fock, Efecto del enriquecimiento de CO 2 de toda la temporada en el cultivo de una planta medicinal, Digitalis lanata, J. Agronomy & Science 164, 168-173 (1990) doi: 10.1111 / j.1439-037X.1990 .tb00803.x
- ↑ Ulrich Lüttge, Manfred Kluge y Gabriela Bauer. Botánica . Wiley-VCH; 5. completamente revisado Edición 2005, ISBN 978-3-527-31179-8 .
- ↑ Ulrich Lüttge y Manfred Kluge: Botánica - Introducción a la biología de las plantas . Wiley-VCH Verlag GmbH & Co. KGaA; 6a edición actualizada 2012, ISBN 978-3-527-33192-5 , p. 498.
- ^ A b Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger - Libro de texto de botánica. 36ª edición. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7 , pág.315.
- ↑ Hermann Linder: Biología . 21., reelaboración. Edición. Schroedel Verlag, 1998, ISBN 3-507-10580-2 , pág.45 .
- ↑ Turrell (1934): El área de la superficie interna expuesta de las hojas de dicotiledóneas. En: American Journal of Botany 23 (4), 255-264, doi: 10.1002 / j.1537-2197.1936.tb08982.x .
- ↑ Ichiro Terashima, Takashi Fujita, Takeshi Inoue, Wah bald Chow, Riichi Oguchi: "La luz verde impulsa la fotosíntesis de las hojas de manera más eficiente que la luz roja en una luz blanca intensa: revisando la enigmática pregunta de por qué las hojas son verdes" ; Physiology of Plants and Cells, Volumen 50, Número 4, 1 de abril de 2009, publicado: 25 de febrero de 2009, páginas 684-697, doi: 10.1093 / pcp / pcp034
- ↑ HH Kim, GD Goins, RM Wheeler, JC Sager: Suplemento de luz verde para mejorar el crecimiento de la lechuga bajo diodos emisores de luz roja y azul. ; HortScience, 2004, diciembre; 39 (7): 1617-1622, PMID 15770792 .
- ^ SW Hogewoning, G. Trouwborst, E. Meinen, W. van Ieperen, (2012): "Encontrar el espectro de luz de crecimiento óptimo para cultivos de invernadero" , Acta Hortic. 956, 357-363, doi: 10.17660 / ActaHortic.2012.956.41 .
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botánica . 5. completamente revisado Edición. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31179-8 , pág.318.
- ↑ B. Steuer, T. Stuhlfauth y HP Fock: La eficiencia del uso del agua en plantas con estrés hídrico aumenta debido al cierre estomático inducido por ABA, Photosynthesis Research 18, 1988, pp. 327–336 doi: 10.1007 / BF00034837
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botánica . 5. completamente revisado Edición. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31179-8 , pág.472.
- ↑ Hermann Linder: Biología . 21., reelaboración. Edición. Schroedel Verlag, 1998, ISBN 3-507-10580-2 , págs. 48-49.
- ^ Departamento de energía de Estados Unidos : ciclo de carbono y biosequetación. Integración de la biología y el clima a través de la ciencia de sistemas. Informe del taller de marzo de 2008. 2008. PDF (16 MB).
- ↑ Jane Reece y otros: Campbell Biology . 10a edición, Pearson, Hallbergmoos 2016, p. 795.
- ↑ ZS Kolber, CL Van Dover, RA Niederman, PG Falkowski: Fotosíntesis bacteriana en aguas superficiales del océano abierto. En: Naturaleza. Volumen 407, Número 6801, septiembre de 2000, págs. 177-179, doi: 10.1038 / 35025044 . PMID 11001053 .
- ↑ Volker Storch, Ulrich Welsch, Michael Wink: Evolutionsbiologie. Springer, 2013, ISBN 978-3-642-32836-7 , pág.93 .
- ↑ EG Nisbet, Nisbet, RE. (2008): Metano, oxígeno, fotosíntesis, rubisco y la regulación del aire a través del tiempo. En: Philos Trans R Soc Lond B Biol Sci . 363 (1504); 2745-2754; PMID 18487133 .
- ↑ a b c Olson, JM. (2006): Fotosíntesis en la era Arcaica. En: Photosynth Res . 88 (2); 109-117; PMID 16453059 ; doi: 10.1007 / s11120-006-9040-5 .
- ↑ Andrew D. Czaja et al.: La oxidación biológica de Fe controló la deposición de la formación de bandas de hierro en el cinturón supracrustal de Ma Isua aproximadamente 3770 (oeste de Groenlandia). En: Letras de Ciencias Planetarias y de la Tierra. Volumen 363, 2013, págs. 192-203, doi: 10.1016 / j.epsl.2012.12.025
- ↑ a b c d Buick, R. (2008): ¿ Cuándo evolucionó la fotosíntesis oxigénica? En: Philos Trans R Soc Lond B Biol Sci . 363 (1504); 2731-2743; PMID 18468984 .
- ^ R. Buick: Vida en el Arcaico. En: Dereck Briggs, Peter R. Crowther: Paleobiology II . Wiley-Blackwell, Oxford 2001, ISBN 978-0-632-05149-6 , págs. 13-21.
- ↑ JL Kirschvink, Kopp, RE. (2008): Casas de hielo paleoproterozoicas y la evolución de enzimas mediadoras de oxígeno: el caso de un origen tardío del fotosistema II En: Philos Trans R Soc Lond B Biol Sci . 363 (1504); 2755-2765; PMID 18487128 .
- ↑ Schidlowski, M. et al . (1983): Inferencias isotópicas de bioquímicas antiguas: carbono, azufre, hidrógeno y nitrógeno. En: JW Schopf (Ed.): La biosfera más temprana de la Tierra: su origen y evolución Prince-ton, Nueva Jersey, Princeton University Press, ISBN 978-0-691-02375-5 .
- ↑ J. Raymond, O. Zhaxybayeva, JP Gogarten, SY Gerdes, Blankenship RE (2002): Análisis de genoma completo de procariotas fotosintéticos. En: Science 298 (5598); 1616-1620; PMID 12446909 ; doi: 10.1126 / science.1075558 .
- ↑ a b A. Y. Mulkidjanian, EV Koonin, KS Makarova, SL Mekhedov, A. Sorokin, YI Wolf, A. Dufresne, F. Partensky, H. Burd, D. Kaznadzey, R. Haselkorn, Galperin MY (2006): La cianobacteria núcleo del genoma y el origen de la fotosíntesis. En: Proc Natl Acad Sci USA 103 (35); 13126-13131; PMID 16924101 ; PMC 1551899 (texto completo gratuito)
- ^ Pennisi, E. (2002): Biología evolutiva. Las bacterias comparten genes de fotosíntesis. En: Science 298 (5598); 1538-1539; PMID 12446882 ; doi: 10.1126 / science.298.5598.1538b .
- ↑ Fuentes de energía con futuro ( DFG )









![{\ mathrm {12 \ H_ {2} O \ {\ xrightarrow {h \ nu}} \ 24 \ [H] +6 \ O_ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8164717f489d1128fdf68c58053651b3ace1f47f)
![{\ mathrm {6 \ CO_ {2} +24 \ [H] \ longrightarrow C_ {6} H _ {{12}} O_ {6} +6 \ H_ {2} O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab734440d539794119fcae6e343b784c286e6de5)